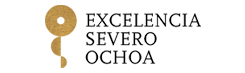Excelencia en divulgación científica
Las principales revistas científicas publican
investigaciones de los laboratorios del CNIC
JACC
Un fármaco de menos de 2 euros demuestra ser útil en pacientes críticos con COVID-19
La expresión más grave de la COVID-19 es la insuficiencia respiratoria severa que requiere intubación y se asocia a alta mortalidad. La infección pulmonar por SARS-CoV2 puede derivar en el desarrollo de un síndrome de distrés respiratorio agudo (SDRA), en el que la inflamación/hiperactivación de los neutrófilos juega un papel central. Actualmente hay una falta de terapias para tratar el SDRA asociado a COVID-19.
El equipo del Dr. Borja Ibáñez, director del Laboratorio Traslacional para la Imagen del CNIC, descubrió recientemente que el metoprolol, un fármaco beta-bloqueante tradicional, tiene un efecto muy selectivo sobre el neutrófilo hiperactivado en condiciones de estrés agudo como el infarto de miocardio. Debido al papel central de neutrófilo en el SDRA, este equipo especuló que el metoprolol podría reposicionarse como terapia en casos de COVID -19 grave.
Madrid-COVID es un ensayo clínico aleatorizado realizado en estrecha colaboración entre el CNIC y los servicios de cardiología, UCI, neumología y biobanco del Hospital Fundación Jiménez Díaz (FJD). El objetivo principal de este ensayo piloto fue estudiar el efecto del tratamiento intravenoso con metoprolol en el infiltrado inflamatorio pulmonar y en la función respiratoria en pacientes con COVID-19 grave que han sido intubados recientemente debido a un SDRA.
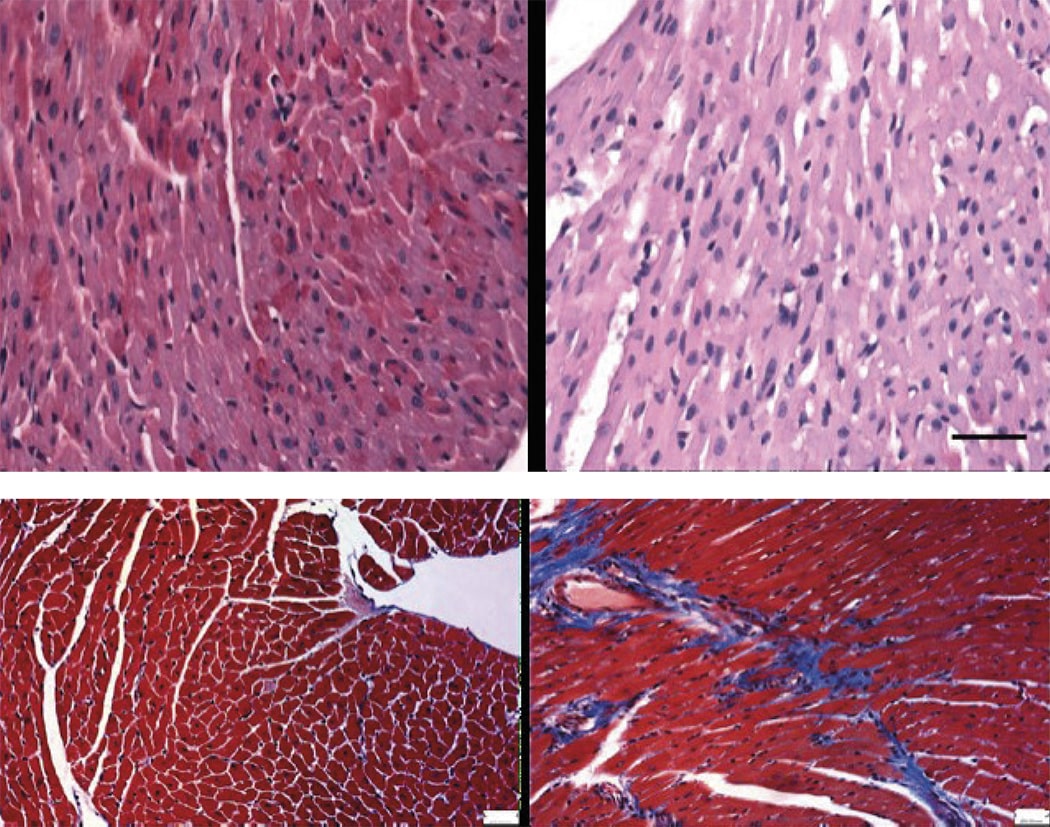
El estudio investigó en 20 pacientes con COVID-19 severo y recién intubados el efecto de metoprolol intravenoso (15 mg diarios durante tres días) o un control (sin recibir metoprolol). “Estudiamos el infiltrado inflamatorio en el líquido broncoalveolar antes y después del tratamiento, así como la evolución clínica en términos de oxigenación y días bajo ventilación mecánica”, señala el Dr. Ibáñez.
Los resultados mostraron que el tratamiento con metoprolol intravenoso (15 mg/día) durante tres días reducía significativamente la infiltración de neutrófilos en los pulmones y mejoraba la oxigenación de los pacientes. El estudio muestra una tendencia clara a que los pacientes que recibían metoprolol necesitaban de menos días bajo ventilación mecánica y por tanto menos días de ingreso en UCI.
El Dr. Ibáñez matiza que, “aunque debemos ser cautos ya que se trata de un estudio piloto inicial, hemos observado que el tratamiento con metoprolol en este contexto clínico es seguro, se asocia a una reducción muy significativa del infiltrado inflamatorio alveolar pulmonar, y esto parece derivar en una mejoría muy rápida de la oxigenación de los pacientes”.
Por eso, los investigadores consideran que el metoprolol intravenoso aparece como una “intervención prometedora que podría mejorar el pronóstico de los pacientes con COVID-19 en estado crítico”, y subrayan que el metoprolol es un fármaco seguro, barato (el tratamiento diario cuesta <2 €), disponible en nuestro entorno, que puede mejorar los resultados en pacientes con COVID-19 grave. El trabajo ha sido un ejemplo de colaboración básico-clínica.
El equipo investigador liderado por el Dr. Ibáñez recibió fondos del Instituto de Salud Carlos III (ISCIII) para realizar un ensayo clínico que demuestre de forma definitiva los beneficios clínicos del metoprolol en 350 pacientes con SDRA ingresados en 14 UCIs españolas. El ensayo clínico “MAIDEN” será coordinado por el CIBER, y participarán grupos del área cardiovascular y respiratorias del mismo.
El estudio ha sido parcialmente financiado por la Comisión Europea (ERC-CoG grant Nº 819775) y el Ministerio de Ciencia e Innovación (MCN; ‘RETOS 2019’ grant Nº PID2019-107332RB-I00). También ha contado con el apoyo del Programa de Atracción de Talento de la Comunidad de Madrid.
Circulation Research
Desvelado un mecanismo que regula la hipertrofia cardiaca
Investigadores del CNIC identificaron un nuevo mecanismo de regulación de la hipertrofia cardiaca, una enfermedad sobre la que todavía hoy día se desconocen en profundidad los mecanismos que la controlan, lo que impide el desarrollo de terapias efectivas.
Los hallazgos, que se publicaron en Circulation Research, pueden ayudar a desarrollar nuevas herramientas terapéuticas para el tratamiento de la hipertrofia cardiaca y, especialmente, para los pacientes con síndrome de Cushing con hipertrofia cardiaca.
Los resultados, explica el Dr. Enrique Lara Pezzi, líder del estudio y jefe del Laboratorio de Regulación Molecular de la Insuficiencia Cardiaca del CNIC, desvelan que la “proteína SRSF4 se une y estabiliza el ARN no codificante GAS5, que a su vez inhibe el receptor de glucocorticoides y previene así la hipertrofia cardiaca”.
Los cardiomiocitos son las células responsables de la contracción del corazón. A pesar de que los cardiomiocitos apenas se pueden dividir en el órgano adulto, muestran una gran capacidad de adaptación a las demandas de contracción del organismo, asegura el Dr. Lara Pezzi.

Un ejemplo de esta capacidad de adaptación es la respuesta a la estenosis aórtica. “Cuando la válvula aórtica no puede abrirse completamente (estenosis), se produce un estrechamiento del orificio por el que el ventrículo izquierdo debe propulsar la sangre hacia el organismo, lo que exige al corazón realizar un esfuerzo mayor en la contracción”.
Y añade que, como los cardiomiocitos no se pueden dividir, “para aumentar la capacidad contráctil del corazón estas células deben acrecentar su tamaño, lo que se conoce como hipertrofia”.
Pero, aunque inicialmente esta respuesta resulta eficaz, el engrosamiento de las paredes del ventrículo izquierdo (hipertrofia cardiaca) provoca cambios estructurales en el corazón, que progresivamente causan una pérdida de capacidad contráctil.
El grupo del Dr. Lara-Pezzi, en colaboración con investigadores del Hospital Puerta de Hierro de Majadahonda, el Centro de Investigación Biomédica en Red Cardiovascular (CIBERCV) y la Universidad de Frankfurt (Alemania), ha analizado los nuevos mecanismos responsables del desarrollo de esta patología.
Los investigadores han visto que los ratones que carecían de SRSF4, una proteína que se une al ARN, desarrollaban hipertrofia cardiaca y presentaban problemas de relajación del músculo cardiaco (disfunción diastólica).
Al analizar los posibles mecanismos moleculares implicados en esta respuesta, el equipo del CNIC encontró que la ausencia de SRSF4 reduce enormemente la expresión de un ARN no codificante llamado GAS5. “La proteína SRSF4 se une directamente a GAS5 y evita que se degrade dentro de la célula. GAS5, a su vez, es un inhibidor del receptor de glucocorticoides, cuya activación puede contribuir al desarrollo de hipertrofia cardiaca”, aclara el Dr. Lara Pezzi.
Tal y como explica el Dr. Javier Larrasa, primer autor del estudio, “la ausencia de SRSF4 provocaba la degradación de GAS5 y, a su vez, la activación del receptor de glucocorticoides, mientras que la sobrexpresión de GAS5 utilizando un vector viral permitió no solo inhibir el receptor de glucocorticoides sino también reducir la hipertrofia del corazón”.
Los investigadores concluyen que la identificación del eje de señalización celular SRSF4-GAS5-receptor de glucocorticoides supone un importante avance en la caracterización de los mecanismos moleculares que controlan la hipertrofia cardiaca y podría ser la base de nuevas terapias.
Los resultados, añaden, podrían ser “particularmente relevantes para pacientes con síndrome de Cushing, que presentan hipertrofia cardiaca causada en parte por activación del receptor de glucocorticoides”.
El estudio ha contado con la ayuda de la Unión Europea (CardioNeT-ITN-289600 y CardioNext-ITN-608027), del Ministerio de Economía y Competitividad, de la Comunidad de Madrid (2010-BMD-2321 “Fibroteam”). También del Plan Estatal de I+D+I 2013-2016 y la iniciativa “A way to build Europe” de la European Regional Development Fund (ERDF).
Scientific Reports
La evaluación 3D del daño cicatricial tras un infarto aumenta el valor pronóstico de la resonancia magnética cardiaca
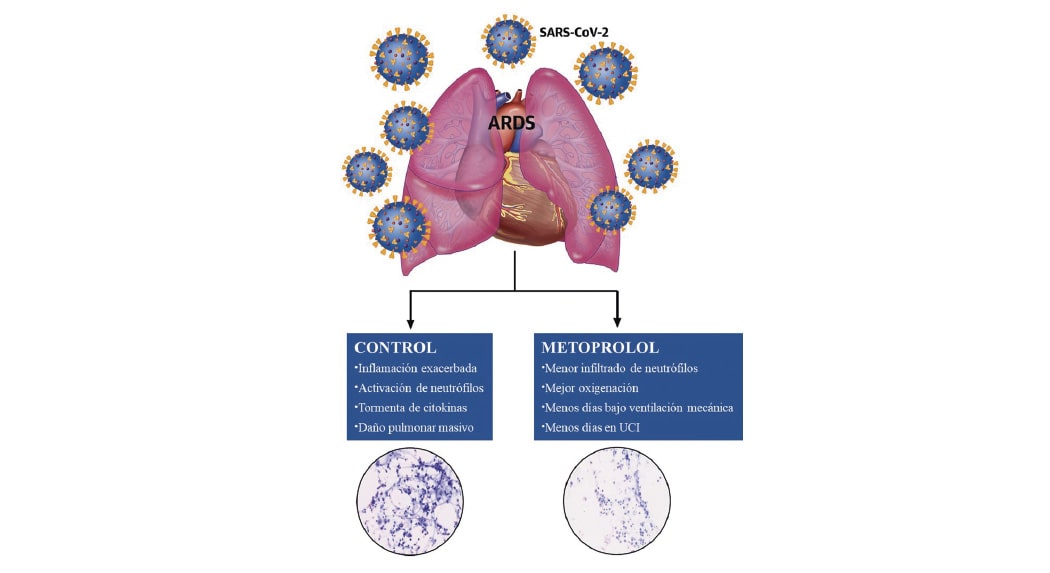
Un trabajo multidisciplinar dirigido por la Universidad de Valladolid y el CNIC, en colaboración con investigadores y clínicos de distintos hospitales y centro de investigación españoles, Philips Healthcare Iberia, el CIBERCV y el CIBERBBN, ha desarrollado una metodología altamente eficiente que permite identificar las características tridimensionales del daño cicatricial presente en pacientes que han sufrido un infarto de miocardio.
Este nuevo método permite la evaluación transmural (a través del grosor de la pared del corazón) y tridimensional del tejido cicatricial del músculo infartado, de tal forma que establece una caracterización altamente detallada del tejido dañado y su disposición espacial. En concreto, la evaluación transmural del infarto hace referencia a una medida de la extensión relativa del tejido infartado y fibroso respecto de la anchura de la pared del miocardio.
Según explica David Filgueiras, “la relevancia de este nuevo método se manifiesta en su utilidad en secuencias convencionales de resonancia magnética nuclear cardiaca, que habitualmente se obtienen en pocos minutos, dentro de agendas frecuentemente saturadas para el uso de los aparatos de resonancia magnética nuclear”.
“Esta novedosa metodología puede representar un enfoque eficiente en la práctica clínica después de la segmentación manual o automática de los bordes del miocardio en una pequeña cantidad de cortes 2D convencionales y detección automática de cicatrices”, escriben los autores del estudio que se publicó en la revista Scientific Reports.
Los resultados de la investigación mostraron que la superficie ocupada por tejido infartado en zonas de transmuralidad baja, entre el 10% (para secuencias de resonancia 3D) y 20% (para secuencias de resonancia 2D convencionales) del grosor de la pared ventricular, es un parámetro asociado a las características de la presentación clínica de las taquicardias vinculadas al tejido infartado del ventrículo, denominadas taquicardias ventriculares.
De forma más específica, las primeras firmantes del trabajo, Susana Merino, de la Universidad de Valladolid, y Lilian Karina Gutiérrez, de CNIC, destacan que “los resultados mostraron una correlación significativa entre la superficie de cicatriz identificada con los mencionados valores de transmuralidad y la frecuencia cardiaca a la se presentaba la taquicardia ventricular a nivel clínico”.
Los datos también mostraron que los pacientes con valores más bajos de superficie de cicatriz en base a los criterios mencionados de transmuralidad tenían una mayor probabilidad de recurrencias de taquicardias ventriculares en el seguimiento a largo plazo.
El potencial de este nuevo método destaca especialmente porque se realiza sobre secuencias convencionales de resonancia magnética cardiaca basadas en adquisiciones 2D con realce tardío, con escaso número de cortes y disponibles en cualquier centro que realice estudios de resonancia magnética nuclear cardiaca. No son necesarios, en consecuencia, estudios 3D.
La metodología se basa en una sinergia de colaboración técnica, experimental y clínica desarrollada dentro de un convenio específico entre la Universidad de Valladolid y CNIC. Según explica Carlos Alberola, co-investigador principal del trabajo, los aspectos técnicos se basan en dos desarrollos tecnológicos previos realizados por el Laboratorio de Procesado de Imagen de la Universidad de Valladolid, con sede en la Escuela Técnica Superior de Ingenieros de Telecomunicación: una metodología de interpolación de imágenes con preservación de topología que consigue aproximar con bastante exactitud las imágenes 3D de alta resolución a partir de las imágenes convencionales empleadas en la clínica y una metodología matemática que permite caracterizar el tejido fibroso del miocardio que se produce tras un infarto, y extender tridimensionalmente y a todos los puntos del miocardio la denominada transmuralidad, es decir, la medida de la extensión relativa del tejido fibroso respecto de la anchura del miocardio.
La investigación ha contado con el apoyo del Ministerio de Ciencia e Innovación (TEC2017-82408-R y PID2019-109329RB-I00); del Fondo Europeo de Desarrollo Regional (CB16/11/00458); la Heart Rhythm Association de la Sociedad Española de Cardiología; la Fundación Interhospitalaria para la Investigación Cardiovascular (FIC); la Fundación Eugenio Rodríguez Pascual; el Programa H2020 de la Unión Europea; el Ministerio de Asuntos Económicos y Transformación Digital, y la Fundación Carolina-BBVA.
Science
Un mecanismo rápido para la autorreparación muscular independiente de las células madre
Se sabe que el músculo regenera a través de un proceso complejo que implica varios pasos y depende de las células madre. Ahora, un estudio liderado por investigadores de la Universitat Pompeu Fabra (UPF) / CNIC / CIBERNED y el Instituto de Medicina Molecular João Lobo Antunes (iMM, Portugal), publicado en la revista Science describe un nuevo mecanismo para la regeneración muscular después de un daño fisiológico. Este nuevo mecanismo de protección, que se basa en la reordenación de los núcleos de las fibras musculares y es independiente de las células madre musculares, abre el camino a una mejor comprensión de la reparación muscular tanto en contexto fisiológico como de enfermedad.
El tejido del músculo esquelético, órgano responsable de la locomoción, está formado por células (fibras) que tienen múltiples núcleos, una característica casi única en nuestro cuerpo. A pesar de la plasticidad de estas fibras, su contracción puede ir acompañada de daño muscular. William Roman, primer autor del estudio e investigador de la UPF, explica: “Incluso en condiciones fisiológicas, la regeneración es vital para que los músculos soporten el estrés mecánico de la contracción, que a menudo provoca daño celular”. Aunque la regeneración muscular se ha investigado profundamente en las últimas décadas, la mayoría de los estudios se han centrado en los mecanismos que involucran a varios tipos celulares, incluidas las células madre musculares, que se requieren en caso de daño muscular extenso”.
“En este estudio encontramos un mecanismo alternativo de reparación del tejido muscular que es autónomo de las fibras musculares”, dice Pura Muñoz-Cánoves, profesora ICREA e investigadora principal en la UPF y el CNIC, y líder del estudio.
Los investigadores (entre ellos Antonio Serrano (UPF) y Mari Carmen Gómez-Cabrera (Universitat de València e INCLIVA)) utilizaron diferentes modelos in vitro de lesión y modelos de ejercicio en ratones y humanos para observar que, al lesionarse, los núcleos son atraídos hacia el lugar del daño, acelerando la reparación de las unidades contráctiles. A continuación, el equipo de investigadores analizó el mecanismo molecular de esta observación: “Nuestros experimentos con células musculares en el laboratorio demostraron que el movimiento de los núcleos a los sitios de lesión provocó la entrega local de moléculas de ARN mensajero (ARNm). Estas moléculas de ARNm son traducidas a proteínas en el lugar de la lesión para actuar como bloques de construcción para reparar el músculo”, explica William Roman. “Este proceso de autorreparación de las fibras musculares se produce rápidamente tanto en ratones como en humanos después de una lesión muscular inducida por el ejercicio, y por lo tanto representa un mecanismo de protección eficiente en términos de energía y tiempo para la reparación de lesiones menores”, añade Pura Muñoz-Cánoves.
Además de sus implicaciones para la investigación muscular, este estudio también introduce conceptos más generales para la biología celular, como el movimiento nuclear hacia los lugares de lesión. “Una de las cosas más fascinantes en estas células es el movimiento durante el desarrollo de sus núcleos, los orgánulos más grandes dentro de la célula, pero las razones por las que los núcleos se mueven son en gran parte desconocidas. Ahora, mostramos una relevancia funcional para este fenómeno en la edad adulta durante la reparación y regeneración celular”, dice Edgar R. Gomes, líder de grupo en el Instituto de Medicina Molecular y profesor de la Faculdade de Medicina da Universidade de Lisboa, quien codirigió el estudio.
Este hallazgo constituye un avance importante en el conocimiento de la biología muscular, en fisiología (incluida la fisiología del ejercicio) y disfunción muscular
Sobre la importancia de estos descubrimientos, coinciden Pura Muñoz-Cánoves, Antonio Serrano y Mari Carmen Gómez-Cabrera: “Este hallazgo constituye un avance importante en el conocimiento de la biología muscular, en fisiología (incluida la fisiología del ejercicio) y disfunción muscular”.
El trabajo se desarrolló en la UPF / CNIC / CIBERNED e iMM en colaboración con la Universitat de València / INCLIVA. Este estudio fue financiado por el Consejo Europeo de Investigación, la Association Française contre les Myopathies, la Organización Europea de Biología Molecular, el Human Frontiers Science Programme y el Ministerio de Ciencia de España.
Circulation
Nunca es demasiado tarde para tratar la progeria
Investigadores del CNIC y del CIBER de Enfermedades Cardiovasculares (CIBERCV), liderados por el Dr. Vicente Andrés, han creado el ratón HGPSrev, el primer modelo animal que desarrolla el Síndrome de Progeria de Hutchinson-Gilford (en inglés, Hutchinson-Gilford Progeria Syndrome o HGPS) pero que permite suprimir de un modo controlado la expresión de progerina, la proteína anómala causante de la enfermedad. Con este nuevo modelo han podido demostrar que nunca es demasiado tarde para tratar la enfermedad.
En el estudio, que se publicó en Circulation, se explica además que las alteraciones cardiovasculares y muerte precoz asociadas a la enfermedad pueden prevenirse con tratamientos restringidos al sistema cardiovascular.
El Síndrome de Progeria de Hutchinson-Gilford es una enfermedad genética ultra rara —afecta a menos de 400 niños en todo el mundo— para la que no hay cura. Está provocada por una mutación en el gen LMNA y se caracteriza por envejecimiento acelerado y muerte en la segunda década de vida, principalmente debido a complicaciones cardiovasculares derivadas de la arteriosclerosis.

En ausencia de mutaciones, el gen LMNA codifica para las laminas de tipo A (lamina A y C). La mutación presente en los pacientes provoca la síntesis de progerina, una proteína anómala cuya acumulación en los tejidos provoca alteraciones moleculares y celulares múltiples que hacen que su vida transcurra a un ritmo muy acelerado, donde los minutos son horas, y las horas son días descontados.
Ahora, gracias al ratón HGPSrev creado en el Laboratorio de Fisiopatología Cardiovascular Molecular y Genética del CNIC, los investigadores han logrado suprimir la expresión de progerina y reestablecer la expresión de lamina A a diferentes edades, tanto en todos los tejidos del organismo como en tipos celulares específicos.
La Dra. Amanda Sánchez López y Carla Espinós Estévez, co-primeras autoras del trabajo, señalan que, a pesar de que hay terapias paliativas que han mostrado eficacia en modelos animales, algunas de las cuales están en ensayos clínicos, el beneficio terapéutico conseguido es muy limitado. “La eliminación de la mutación causante de la enfermedad debería ser, teóricamente, la cura real —añaden—. Sin embargo, hasta que esto sea posible, y teniendo en cuenta que la progeria se diagnostica cuando ya son evidentes sus primeros síntomas, quisimos investigar si es posible revertir los síntomas cuando ya están presentes, y cuánto puede retrasarse el inicio del tratamiento para conseguir beneficio terapéutico”.
Los resultados demuestran que el ratón HGPSrev desarrolla los síntomas principales de la enfermedad humana incluyendo problemas de crecimiento, lipodistrofia, alteraciones cardiovasculares y muerte precoz.
Además, constatan que la eliminación de progerina y restauración de lamina A aumenta la esperanza de vida en un 84,5% cuando se realiza en animales que presentan síntomas muy leves, pero también la acrecienta en un 6,7% en ratones con síntomas muy avanzados.
Estos datos, asegura el Dr. Andrés, explican por primera vez que iniciar el tratamiento cuando los síntomas son leves tiene un gran efecto terapéutico, pero que nunca es demasiado tarde para lograr beneficio.
Los investigadores concluyen que estos resultados “pueden ser de gran valor para el desarrollo de futuras estrategias terapéuticas en el ámbito clínico, ya que sugieren que terapias dirigidas exclusivamente al sistema cardiovascular podrían provocar un beneficio muy significativo en la calidad y esperanza de vida de los pacientes”.
Este estudio ha sido posible gracias al apoyo del Ministerio de Ciencia e Innovación (MCIN)/Agencia Estatal de Investigación (AEI)/10.13039/501100011033 (grants SAF2016-79490-R, PID2019-108489RB-I00, SVP-2014-068334, FJCI-2017-33299); el Instituto de Salud Carlos III (ISCIII; grant AC17/00067-TREAT-HGPS), un proyecto del E-Rare Joint Transnational call, European Union Horizon 2020 Framework Programme 2017; el Fondo Europeo de Desarrollo Regional (“Una manera de construir Europa”); el Wellcome Trust (grant 098291/Z/12/Z); la Comunidad Autónoma de Madrid (grant 2017-T1/BMD-5247); la Asociación Apadrina la Ciencia-Ford España-Ford Motor Company Fund; y la Fundación “la Caixa”.
Science Advances
Identifican un gen esencial para el desarrollo de la placenta
Investigadores del Centro Nacional de Investigaciones Cardiovasculares (CNIC) han identificado, en un modelo de ratón, un gen que resulta esencial para el desarrollo de la placenta durante la fase embrionaria.
Los datos de su trabajo, que se publicó en Science Advances, indican que el receptor 126 acoplado a proteína G (GPR126) es esencial para el desarrollo de un tipo celular específico en la placenta que regula el remodelado de la vasculatura uterina. Las anomalías cardiacas en los mutantes murinos para Gpr126 son secundarias a defectos placentarios, lo que refleja la relación íntima entre la placenta y el corazón fetal.

Además, GPR126 puede jugar un papel similar en el desarrollo placentario de los humanos. Se ha visto que los hijos de mujeres portadoras de mutaciones en GPR126 fallecían durante su gestación o al poco de nacer, y el 30% de las madres sufrían de preeclampsia, condición que afecta al 5-8% de los embarazos y consiste en un incremento de la presión arterial que afecta a la madre y al feto, pudiendo causar la muerte de este.
Se sabe que el gen GPR126 es necesario para la maduración del sistema nervioso periférico (SNP), la formación de los huesos y cartílagos y el desarrollo del oído interno en modelos animales. En humanos, las mutaciones en GPR126 se han asociado con malformaciones en el esqueleto y contracturas congénitas de las extremidades.
El grupo de Señalización Intercelular durante el Desarrollo y la Enfermedad Cardiovascular del CNIC, que dirige el Dr. José Luis de la Pompa, identificó inicialmente a GPR126 como un gen regulado por la vía de señalización NOTCH (un sistema de señalización celular altamente conservado en los animales) durante el desarrollo cardiaco.
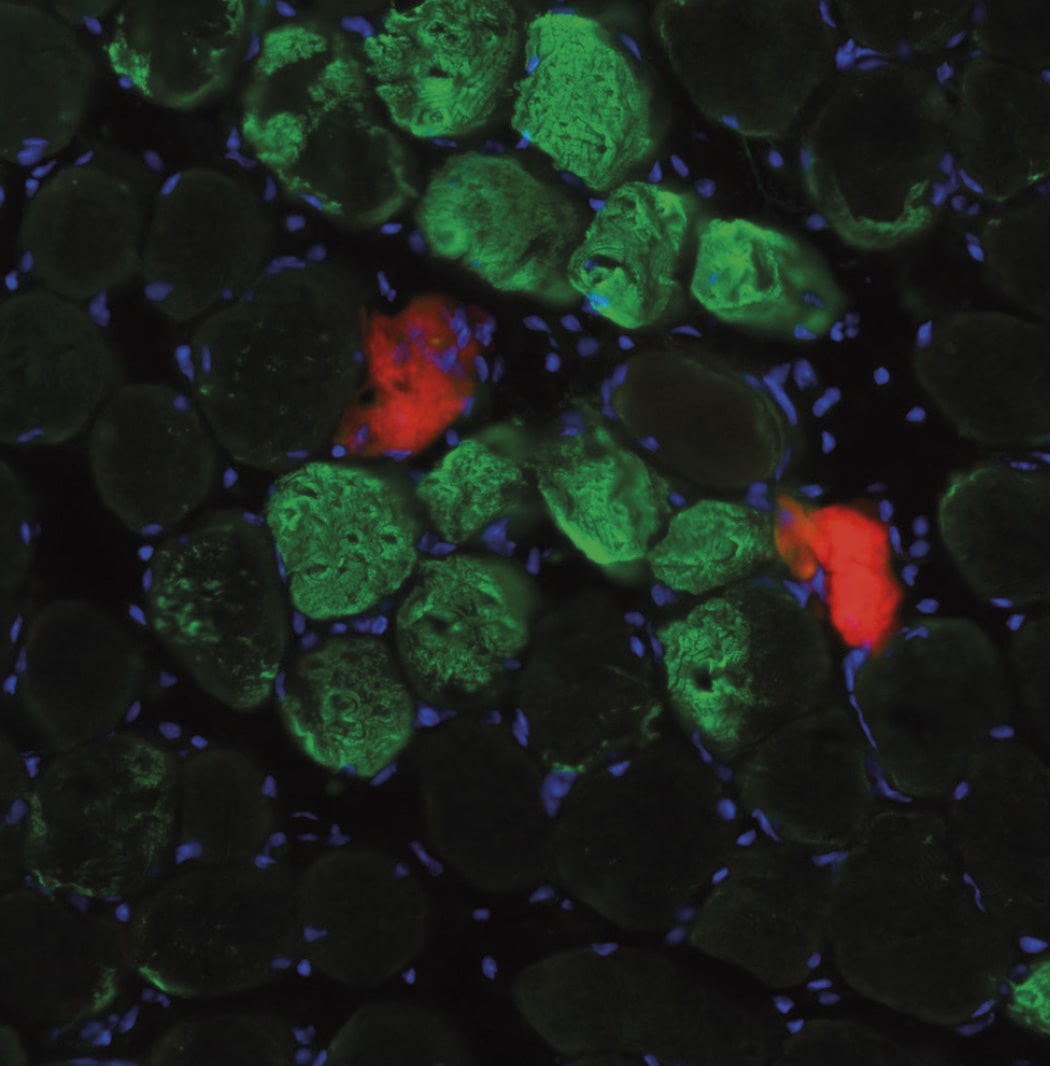
Ello les hizo pensar que GPR126 podría influir en la proliferación y diferenciación de los cardiomiocitos (células cardiacas) en el corazón en desarrollo.
Previamente, otros grupos habían propuesto que GPR126 se requería para el desarrollo cardiaco en ratones y en pez cebra, sin embargo, no se había establecido definitivamente si esta hipótesis era cierta.
En el estudio el grupo demuestra, utilizando técnicas genéticas, que GPR126 no es necesario para el desarrollo del corazón en el ratón, pero sí tiene un papel esencial de GPR126 en la formación de la placenta o placentación.
“Hemos visto —explica el Dr. De la Pompa— que la inactivación global de GPR126 en ratones provoca un adelgazamiento de las paredes del corazón y la muerte embrionaria”. Sin embargo, continúa, “su inactivación específica en el corazón no afecta el desarrollo embrionario ni altera la función cardiaca”.
Por el contrario, la expresión de GPR126 únicamente en el corazón “no rescata la letalidad de ratones deficientes en GPR126, lo que indica que la muerte embrionaria no se debe a un desarrollo cardiaco defectuoso”, explica Rebeca Torregrosa, primera autora del estudio. Utilizando el modelo de pez cebra, los investigadores concluyen que GPR126 “tampoco está implicado en el desarrollo del corazón”.
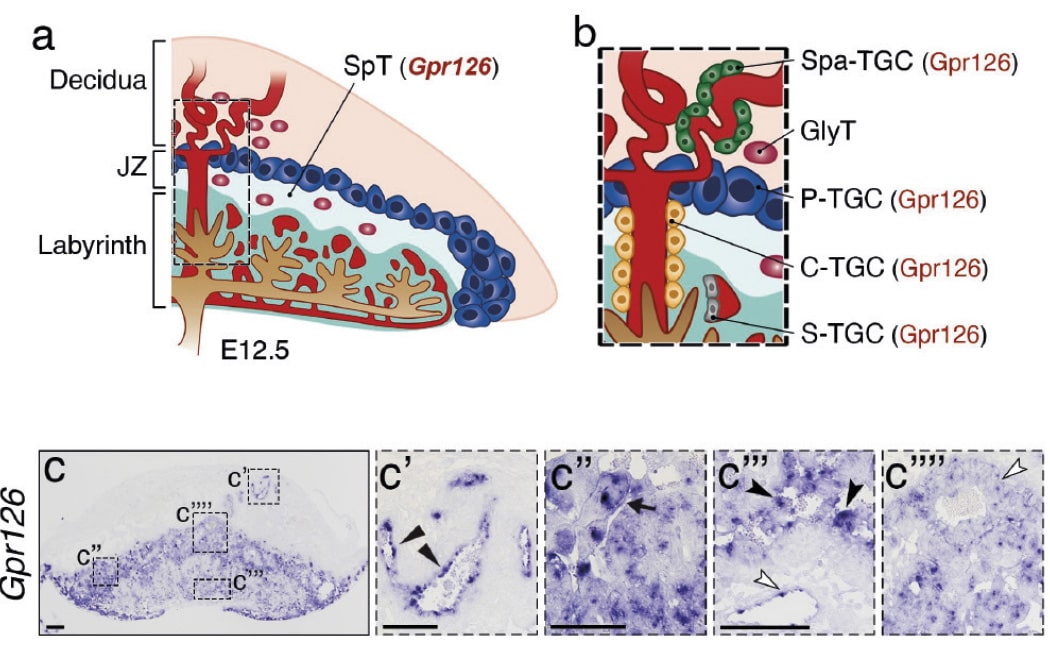
Durante el desarrollo embrionario, GPR126 se expresa también en un tipo celular específico de la placenta, las células gigantes del trofoblasto. “Estas células —señala De la Pompa— son de vital importancia para la implantación del embrión y el mantenimiento del embarazo.
El grupo ha demostrado que la inactivación de GPR126 en el embrión permite la supervivencia si la placenta tiene una copia normal del gen, mientras que su inactivación conjuntamente en el embrión y en la placenta causa la muerte embrionaria.
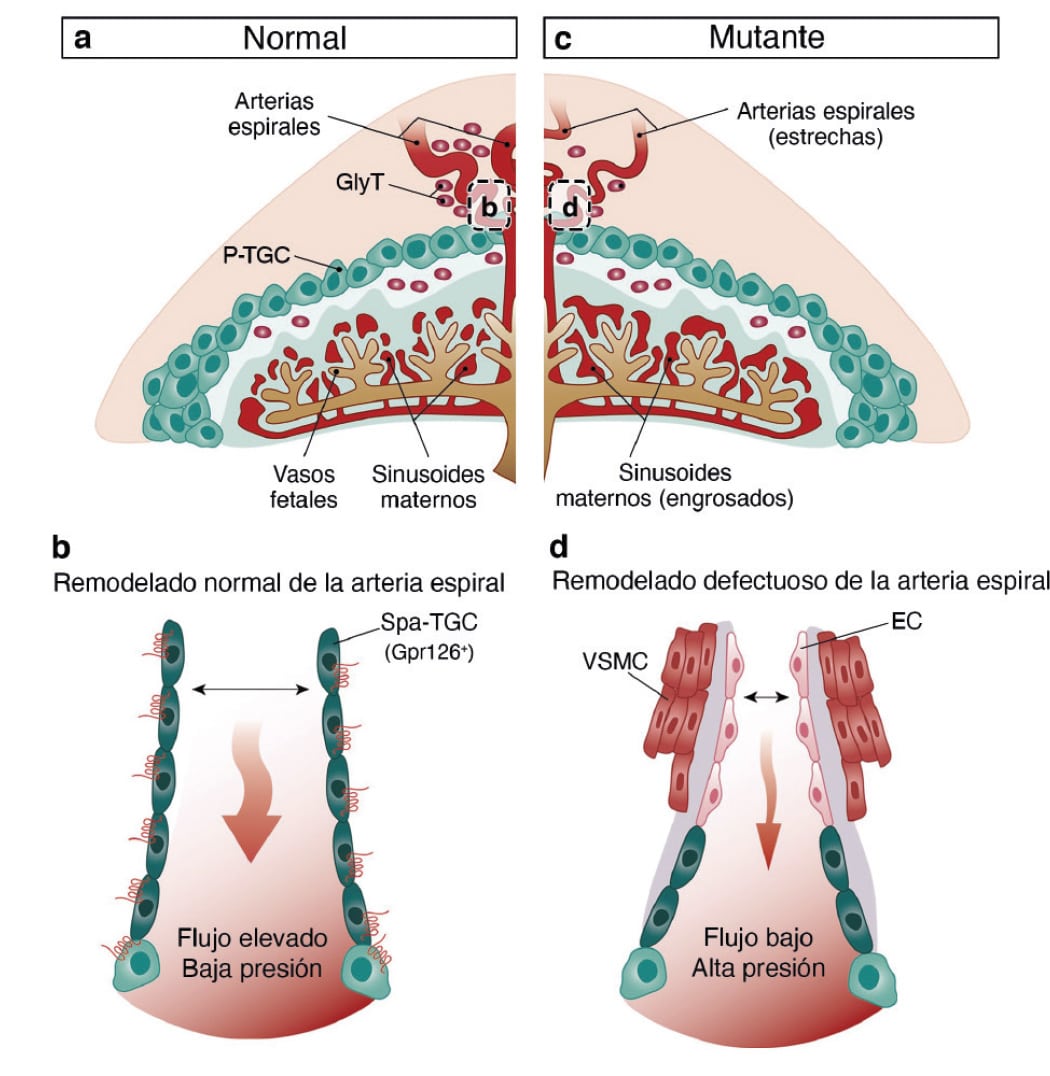
“Un paso crucial en el desarrollo placentario es la remodelación de las arterias maternas que forman parte de la placenta, conocidas como arterias espirales, las cuales aumentan de diámetro para permitir un incremento del flujo sanguíneo hacia el embrión. Fallos en este proceso están asociados a patologías del embarazo como la preeclampsia, la restricción del crecimiento intrauterino e incluso abortos”, detalla José Luis de la Pompa.
El estudio demuestra que GPR126 es esencial en el trofoblasto para la expresión de proteasas específicas implicadas en la remodelación de las arterias espirales durante el desarrollo placentario, lo que es imprescindible para la viabilidad embrionaria
Los investigadores agregan que los ratones deficientes en GPR126 constituyen un modelo experimental para estudiar el remodelado de las arterias espirales y la preeclampsia, y abren una posible vía de aplicación clínica en estudios de diagnóstico genético preimplantacional.
La investigación ha recibido financiación de CIBER CV (PID2019-104776RB-I00, CB16 / 11/00399), TERCL (RD16 / 0011/0021) del Ministerio de Ciencia Innovación y Universidades (MCIU) de España, la Fundación BBVA, la Fundación “La Caixa”, una beca EMBO, beca de viaje Boehringer Ingelheim Fonds, y el Programa de Atracción de Talento de la Comunidad de Madrid (Ref.2016T1 / BMD1540).
Frontiers IN Immunology
Demuestran cómo la inmunidad innata entrenada protege frente al SARS-CoV-2 y potencia las vacunas de la COVID-19
La llegada de las vacunas contra la COVID-19 supuso la mejor arma contra la pandemia causada por el coronavirus SARS-CoV-2. A su vez, ha puesto de manifiesto la necesidad de disponer de herramientas efectivas y rápidas contra la aparición de nuevos virus. Esto puede conseguirse mediante la activación, o entrenamiento, de un tipo de respuesta inmunitaria en nuestro organismo: el sistema inmunitario innato. Esto es lo que se ha demostrado en un trabajo conjunto de numerosas instituciones coordinado por los investigadores Carlos del Fresno, del Instituto de Investigación Sanitaria del Hospital Universitario La Paz (IdiPAZ), Juan García Arriaza y Mariano Esteban, del Centro Nacional de Biotecnología (CNB) del Consejo Superior de Investigaciones Científicas (CSIC), y David Sancho, del Centro Nacional de Investigaciones Cardiovasculares (CNIC).
En este estudio, publicado en la revista Frontiers in Immunology, los investigadores han demostrado que una inmunoterapia compuesta de bacterias muertas, denominada MV130 y producida por la empresa española Inmunotek S.L. (Alcalá de Henares), protege contra la infección causada por el coronavirus SARS-CoV-2 en ratones susceptibles a dicho virus, en experimentos realizados en el Centro de Investigación en Sanidad Animal (CISA), del Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria (INIA-CSIC), en Madrid. Así, la mortalidad de los animales infectados fue significativamente menor cuando recibieron la inmunoterapia con MV130 de modo previo a la infección. Esta inmunoterapia entrena el sistema inmunitario innato a través de la inducción de cambios epigenéticos en las células inmunitarias innatas, tal y como se ha demostrado en otros estudios del grupo del Dr. Sancho.
Los investigadores han evaluado si esta inmunoterapia, aplicada de modo previo a la administración de las vacunas, podría mejorar las respuestas inmunitarias generadas por vacunas contra la COVID-19. Para ello, en experimentos realizados en el CNIC, inocularon en ratones tratados o no tratados con MV130 dos tipos diferentes de vacunas: una basada en la vacuna del CSIC llamada MVA-CoV2-S (generada por el grupo de los Dres. García Arriaza y Esteban) y otra basada en proteína S recombinante con adyuvante, que fueron administradas por dos rutas diferentes, con una inyección intramuscular o a través de la mucosa nasal.
“El resultado obtenido reveló que aquellos animales que recibían MV130 de modo previo a la vacunación y, por tanto, tenían el sistema inmunitario innato entrenado mostraban mejores respuestas inmunitarias tras la vacunación”, señala Carlos del Fresno. En concreto, añade, “MV130 aumentaba la activación de las células T CD8 citotóxicas, encargadas de eliminar las células infectadas, así como los niveles de anticuerpos IgA frente a la proteína S del SARS-CoV-2 en las mucosas”.
Este trabajo demuestra, recalca Juan García Arriaza, “que la inmunoterapia con MV130 protege de manera directa contra la mortalidad por coronavirus SARS-CoV-2 y, por otro lado, favorece una inmunidad innata entrenada que ayuda a mejorar las respuestas inmunitarias generadas por las vacunas contra la COVID-19”.
“Se trata de unos resultados relevantes que indican que, en el caso de futuras nuevas infecciones causadas por patógenos emergentes, la inmunoterapia con MV130 podría proteger a grupos particularmente sensibles al patógeno hasta la llegada de vacunas específicas frente a antígenos asociados al patógeno”, destaca Mariano Esteban.
Asimismo, comenta el Dr. David Sancho, “hemos colaborado en un ensayo clínico en el que se demostró efectividad de MV130 en protección frente a infecciones respiratorias recurrentes en niños, que epidemiológicamente son de etiología vírica”. Este ensayo se publicó en American Journal of Respiratory and Critical Care Medicine, la revista internacional más prestigiosa de neumología y cuidados intensivos.
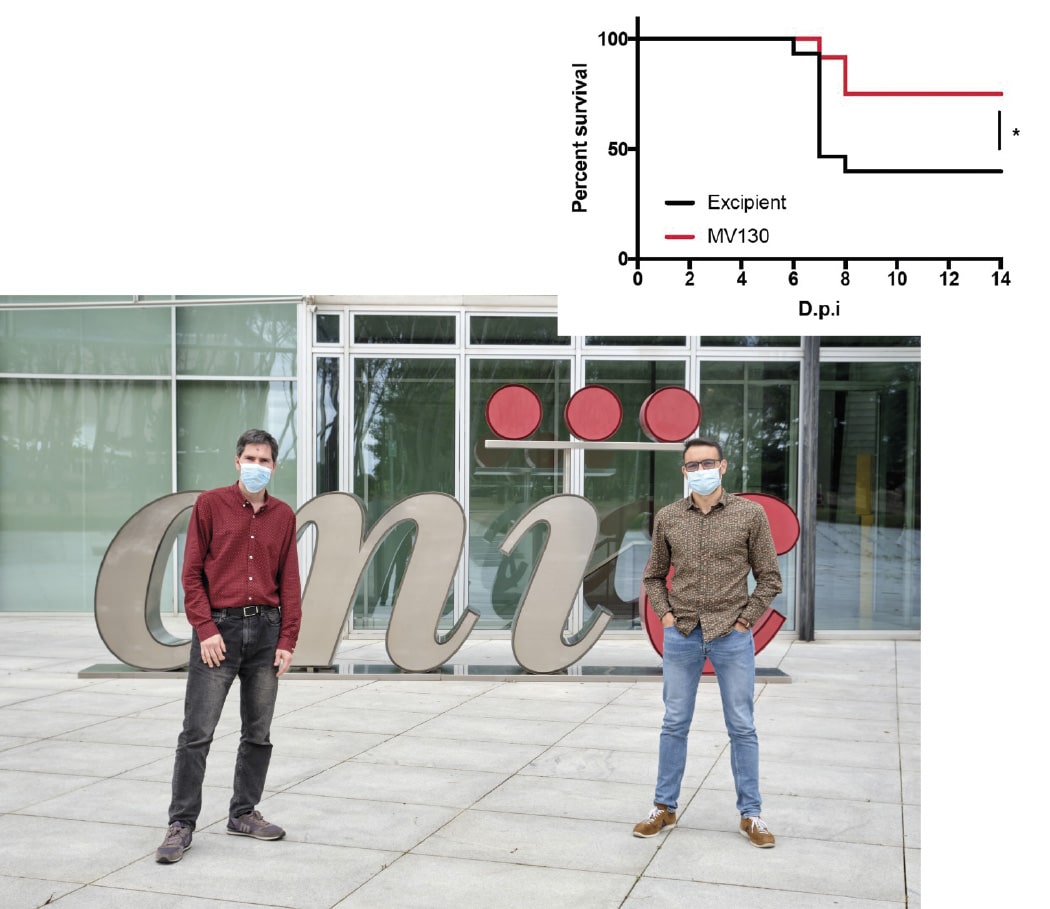
Ratones transgénicos K18-hACE2 recibieron excipiente o MV130 por vía intranasal durante dos semanas. Una semana después de la última administración, los ratones fueron infectados con 104 PFU de SARS-CoV-2 (cepa MAD6). Se siguió la supervivencia de los ratones en respuesta a la infección y se indica el porcentaje de supervivencia. Se realizaron dos experimentos independientes (n=15 excipiente; n=12 MV130). D.p.i.: días tras la infección. *p<0.05, Mantel-Cox test.
Estos resultados, concluyen los investigadores, demuestran que la utilización de MV130 como inmunoterapia permitiría mejorar la eficacia e inmunogenicidad de las vacunas, particularmente en ciertos segmentos de población o frente a variantes del patógeno que puedan reducir la eficacia de la vacuna, contribuyendo a una mejor protección de la población contra la COVID-19.
Este proyecto ha sido posible gracias a la financiación del “Fondo Solidario Juntos” del Banco Santander al proyecto del Dr. David Sancho en el CNIC y al “Fondo COVID-19” del Instituto de Salud Carlos III (ISCIII) otorgado al Dr. Juan García Arriaza. Otras entidades financiadoras son: Fundación Asociación Española Contra el Cáncer (AECC); Fondo Supera COVID-19 (Crue Universidades-Banco Santander); Fundación “la Caixa”; Programa Horizonte 2020 y Beca Marie Skłodowska-Curie de la Unión Europea; beca EMBO; Comunidad de Madrid y Fondo Social Europeo y Desarrollo Regional Europeo; Consejo de Investigación Europea (ERC-2016-Consolidator Grant 725091); Agencia Estatal de Investigación (PID2019-108157RB); Comunidad de Madrid; Inmunotek S.L., y Fundació La Marató de TV3.
PLoS Biology
Descubren dos proteínas esenciales para el metabolismo del corazón de los recién nacidos

Investigadoras del CNIC descubrieron dos proteínas esenciales para el metabolismo cardiaco tras el nacimiento. Su importancia es “clave”, se explica en un estudio publicado en la revista PLoS Biology, ya que la alteración del metabolismo cardiaco durante esos primeros días produce daños cardiacos irreversibles y una alteración de todo el metabolismo que causa diabetes y la reducción de la capacidad termorreguladora de los animales.
Afortunadamente, las investigaciones muestran que “estos efectos podrían llegar a ser tratados mediante un cambio en la alimentación”, asegura la Dra. Guadalupe Sabio, directora del grupo que ha llevado a cabo estos descubrimientos.
Durante el desarrollo embrionario y los primeros días tras el nacimiento, la principal fuente energética del corazón proviene de la glucosa que se almacena en forma de glucógeno. Sin embargo, tras el nacimiento, el corazón sufre un periodo de crecimiento acelerado que hace necesario un gran aporte energético, por lo que, como explica la autora principal del estudio, Ayelén Santamans, el corazón tiene que ser “mucho más eficiente en la obtención de energía”.
El descubrimiento muestra que las proteínas p38γ y p38δ se activan en el corazón al poco de nacer y reducen la actividad de la enzima responsable de la producción del glucógeno. Esto desencadena un cambio metabólico en el corazón, que empieza entonces a utilizar ácidos grasos para producir su energía.
La alteración del metabolismo cardiaco durante el desarrollo postnatal provoca daños irreversibles cuyas consecuencias se hacen patentes en la etapa adulta: resistencia a la insulina, intolerancia a la glucosa y problemas para mantener la temperatura corporal.
Pero en este estudio se ha visto que, si la causa es que el corazón no obtiene la suficiente energía, los daños se pueden corregir mediante un cambio en la alimentación. Para demostrarlo, las investigadoras administraron a las madres una dieta rica en grasas.
Los resultados mostraron que los recién nacidos no presentaban ni daño cardiaco ni tampoco los síntomas de diabetes que se observan cuando estas dos proteínas descubiertas no se activan en el momento adecuado del desarrollo.
Este trabajo indica, por primera vez, que el metabolismo del corazón durante la etapa postnatal es clave en la regulación del metabolismo de todo el organismo. De hecho, explican las autoras, lo que han descubierto es “que el aumento gradual de la actividad de p38γ y p38δ está muy bien controlado y que su alteración conduce a un déficit energético perjudicial tanto para el corazón como para el metabolismo del resto del cuerpo”.
Las investigadoras consideran que tanto p38γ como p38δ podrían estar detrás de algunas de las enfermedades congénitas de origen cardiometabólico cuya causa se desconoce en la actualidad. Además, sugieren que la suplementación alimentaria podría ser un tratamiento válido para tratar este tipo de enfermedades.
En este trabajo han participado investigadores de varios grupos del CIBER de las áreas de Fragilidad y Envejecimiento Saludable (CIBERFES), Enfermedades Cardiovasculares (CIBERCV), Diabetes y Enfermedades Metabólicas asociadas (CIBERDEM) y Enfermedades Hepáticas y Digestivas (CIBEREHD). Asimismo, la investigación ha recibido apoyo de las siguientes entidades financiadoras: EFSD, Lilly European Diabetes Research Programme; Ministerio de Ciencia, Innovación y Universidades; Comunidad de Madrid; Fundación Jesús Serra; Instituto de Salud Carlos III, y Fundación “la Caixa”.