EXCELENCIA EN DIVULGACIÓN CIENTÍFICA
Las principales revistas científicas publican investigaciones de los laboratorios del CNIC
Nature Communications
Una investigación identifica una proteína clave para ‘quemar’ grasa

Una investigación realizada en el CNIC y el CNIO, liderada por Guadalupe Sabio y Cintia Folgueira, descubrió una de las formas en que el organismo quema la grasa de tipo marrón, o grasa parda, y la convierte en calor. Este mecanismo protege contra la obesidad y contra las enfermedades metabólicas relacionadas con la obesidad.
El mecanismo ahora identificado está controlado por la proteína llamada MCJ, presente en las mitocondrias (los orgánulos de la célula donde se produce energía). Sabio y Folgueira han descubierto que, cuando se elimina la proteína MCJ en ratones con obesidad, estos animales producen más calor y pierden peso. Las investigadoras también han conseguido reducir el peso de ratones con obesidad solo trasplantándoles grasa sin esa proteína.
La obesidad puede deberse a una ingesta excesiva o a un bajo gasto energético. El tejido adiposo, más allá de almacenar energía, regula su uso. Existen dos tipos: el blanco (almacena energía) y el pardo (genera calor). Investigaciones recientes han demostrado que la grasa parda usa varios mecanismos para producir calor. Un estudio de Sabio y Folgueira mostró que eliminar la proteína MCJ en ratones obesos aumenta la producción de calor y favorece la pérdida de peso, incluso con solo trasplantar grasa parda sin dicha proteína.
Las investigadoras observaron además “que los animales sin MCJ en la grasa parda están protegidos frente a los problemas de salud que provoca la obesidad, como diabetes o aumento de lípidos en sangre”, explican ambas científicas. Por ello piensan que la proteína MCJ puede ser una nueva diana terapéutica para corregir patologías asociadas a la obesidad.
Communications Biology
El linaje mitocondrial europeo podría ofrecer protección contra la gravedad del COVID-19
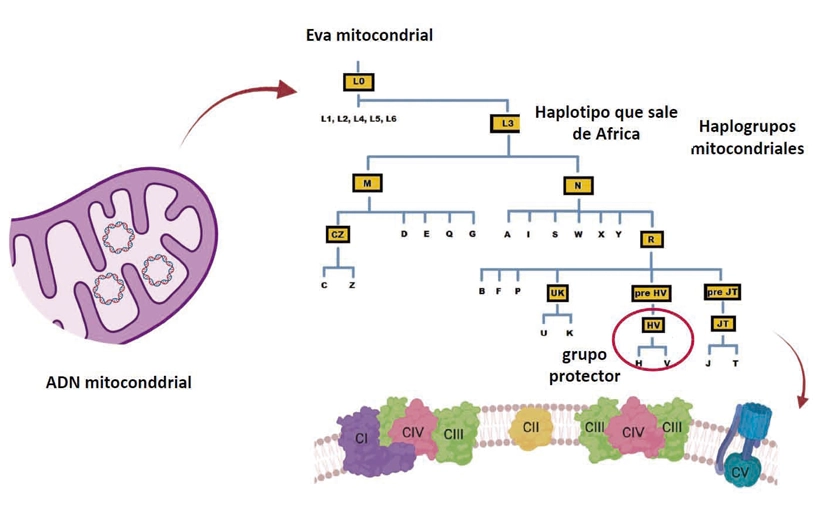
Una investigación publicada en la revista Communications Biology identificó que ciertas variantes genéticas presentes en el ADN mitocondrial de la población europea podrían ofrecer protección frente a formas graves de COVID-19. El estudio, liderado por el grupo GENOXPHOS del CNIC y CIBERFES, y dirigido por el Dr. José Antonio Enríquez, proporcionaría nuevas claves sobre la diferente respuesta individual a infecciones.
En el trabajo se han identificado patrones que apuntan a una posible relación entre ciertos haplogrupos mitocondriales (variaciones genéticas que se heredan y comparten entre individuos con un ancestro común) y la susceptibilidad de desarrollar casos más graves de COVID-19.
Los resultados abren nuevas vías para comprender la variabilidad en la respuesta a la infección por SARS-CoV-2 y podrían tener implicaciones importantes para el manejo personalizado de pacientes con COVID-19.
Un estudio con más de 14.300 pacientes de la cohorte SCOURGE identificó que personas con variantes genéticas del linaje mitocondrial HV “frecuente en Europa” presentaban menor riesgo de desarrollar cuadros críticos. Estas variantes, heredadas por vía materna, influyen en la producción de energía celular y en la respuesta inflamatoria.
La investigación contó con la participación de prestigiosas instituciones nacionales e internacionales, incluyendo, además del CNIC y el CIBER, la Universidad de Santiago de Compostela (USC), el Hospital Universitario Marqués de Valdecilla-IDIVAL, el Hospital Universitario Nuestra Señora de Candelaria, el Hospital Universitario La Paz o la Universidad Autónoma de Nuevo León (México), entre otras.
Los resultados no solo contribuyen a la comprensión de la COVID-19, sino que también podrían tener implicaciones en el estudio de otras enfermedades infecciosas y su relación con la genética mitocondrial.
Immunity
Descubren cómo el intestino puede influir en el desarrollo de enfermedades inflamatorias o cardiovasculares

Una investigación liderada por el Dr. David Sancho, del CNIC describió cómo el aumento de la permeabilidad intestinal permite a las bacterias de la microbiota atravesar la barrera intestinal y llegar a la médula ósea, donde inducen cambios en las células madre que generan las células inmunitarias. Las bacterias provocan cambios epigenéticos en las células inmunitarias, que son modificaciones que controlan la actividad de los genes sin alterar su secuencia de ADN.
Estos cambios epigenéticos generan células inmunitarias “entrenadas”, capaces de responder con mayor eficacia frente a infecciones futuras. Sin embargo, esta misma capacidad para una respuesta exacerbada puede también contribuir al mayor desarrollo de enfermedades inflamatorias, como problemas cardiovasculares o neurodegenerativos.
La investigación publicada en la revista Immunity destaca el papel clave de una proteína llamada Mincle y expresada por las células de la inmunidad innata en este proceso. El estudio se ha realizado en colaboración con los equipos de investigación de José Luis Subiza (Inmunotek S.L., Alcalá de Henares), Carlos del Fresno (IdiPaz, Madrid), Salvador Iborra (Universidad Complutense de Madrid) y Juan Duarte (Universidad de Granada).
La inmunidad entrenada permite al sistema inmunitario innato mejorar su respuesta ante futuras infecciones. Investigaciones del CNIC mostraron que bacterias como Enterococcus faecalis pueden inducir esta memoria a través del receptor Mincle en la médula ósea, provocando cambios epigenéticos. Aunque esta respuesta fortalece la defensa frente a infecciones, también puede favorecer enfermedades inflamatorias. El aumento de la permeabilidad intestinal potencia este proceso. En modelos animales, bloquear el receptor Mincle redujo la inflamación, lo que plantea posibles aplicaciones terapéuticas.
Los hallazgos destacan la importancia de una dieta equilibrada y una microbiota sana.
Este estudio ha sido financiado por el Ministerio de Ciencia, Innovación y Universidades-Agencia Estatal de Investigación (AEI), Unión Europea NextGenerationEU/PRTR; Comunidad de Madrid; Fundación Científica de la Asociación Española Contra el Cáncer; Worldwide Cancer Research; European Research Council; Inmunotek S.L., y Fundación “la Caixa”.
Robles-Vera I, Jarit-Cabanillas A, Brandi P, Martínez-López M, Martínez-Cano S, Rodrigo-Tapias M, Femenía-Muiña M, Redondo-Urzainqui A, Núñez V, González-Correa C, Moleón J, Duarte J, Conejero L, Mata-Martínez P, Díez-Rivero CM, Bergón-Gutiérrez M, Fernández-López I, Gómez MJ, Quintas A, Dopazo A, Sánchez-Cabo F, Pariente E, Del Fresno C, Subiza JL, Iborra S, Sancho D. Microbiota translocation following intestinal barrier disruption promotes Mincle-mediated training of myeloid progenitors in the bone marrow. Immunity. 2025 Feb 11; 58 (1-16). doi: 10.1016/j.immuni.2024.12.012JACC CardioOncology
Identifican una terapia efectiva para prevenir el daño cardiaco inducido por un grupo de fármacos para tratar el cáncer

Un equipo del CNIC, en colaboración con instituciones internacionales, identificó una estrategia innovadora para prevenir la cardiotoxicidad inducida por un grupo de medicamentos utilizados habitualmente para tratar el cáncer, las antraciclinas. La cardiotoxicidad es un efecto secundario severo y común de estos tratamientos oncológicos. El estudio, publicado en la revista JACC: CardioOncology, señala el potencial de la empagliflozina, un fármaco inhibidor de SGLT2, para mitigar el daño cardíaco asociado a estas terapias.
El equipo del CNIC utilizó un modelo experimental avanzado que mostró cómo la administración de empagliflozina, en dosis de 20 mg diarios, preservaba la función contráctil del corazón y mejoraba el metabolismo del músculo cardíaco. Herramientas diagnósticas avanzadas como la resonancia magnética y la espectroscopia, que evalúan la generación de energía en el corazón, jugaron un papel clave en esta investigación.
El mecanismo de protección identificado se relaciona con una mejora en el consumo de cuerpos cetónicos (moléculas producidas por el hígado durante la cetogénesis para suministrar energía al cuerpo cuando los niveles de glucosa son bajos) por parte del miocardio, lo que preserva la producción de ATP (adenosín trifosfato, la principal molécula que almacena y transporta energía en las células para realizar procesos vitales) y la función mitocondrial.
El trabajo demuestra que la empagliflozina previene alteraciones estructurales como la atrofia celular y el daño al ADN en los cardiomiocitos. Esto refuerza el potencial de los inhibidores de SGLT2 no solo en el tratamiento de la insuficiencia cardíaca, sino también como intervención preventiva en pacientes oncológicos sometidos a terapias con efectos secundarios cardiovasculares severos”.
Este trabajo, financiado por la Comisión Europea (ERC-CoG 819775), el Ministerio de Ciencia, Innovación y Universidades de España y la Comunidad de Madrid, abre la puerta a futuros ensayos clínicos en pacientes de alto riesgo.
Nature
Descubren un tipo de células inmunes que producen “escudos” defensivos en la piel

Un equipo del CNIC, liderado por Andrés Hidalgo descubrió un tipo especial de neutrófilos en la piel que producen matriz extracelular, ayudando a mantener su resistencia e integridad. El estudio, publicado en Nature, muestra que el sistema inmunológico no solo combate infecciones, sino que también refuerza físicamente la piel para prevenirlas.
Los neutrófilos, células inmunitarias de la sangre, penetran en la piel para generar colágeno y otras proteínas, fortaleciendo la barrera cutánea. Este hallazgo abre nuevas vías para entender el sistema inmunológico y podría inspirar tratamientos para enfermedades de la piel, inflamación, diabetes y envejecimiento.
Tradicionalmente conocidos por su función de defensa ante infecciones, el trabajo desvela un papel inesperado para los neutrófilos: la generación y remodelación de la matriz extracelular de la piel, esencial para mantener la estructura y función de la piel y otros tejidos, actuando como barrera ante la entrada de microorganismos y sustancias dañinas.
La investigación demostró que estos neutrófilos refuerzan la piel en condiciones normales y reaccionan de manera activa ante las lesiones, formando estructuras protectoras alrededor de heridas para evitar la entrada de bacterias y toxinas.
Además, el estudio reveló que esta función estructural de los neutrófilos está regulada por la vía de señalización del TGF-β. Al desactivar este mecanismo, los investigadores observaron una disminución en la formación de matriz extracelular, lo que produjo una piel más frágil y permeable.
Otro resultado fascinante que se desprende de la investigación es que estos neutrófilos actúan de manera circadiana, regulando la producción de matriz extracelular según el ritmo biológico del organismo, de modo que en los ratones la piel es más resistente durante la noche que durante el día gracias a la acción de los neutrófilos.
Este estudio ha sido financiado por la Fundación “la Caixa”, la Fundación Boehringer Ingelheim, los National Institutes of Health, y la Fundación Nacional Suiza para la Ciencia.
NEJM
Demuestran que un fármaco para la diabetes mejora el pronóstico de pacientes sometidos a intervención valvular cardiaca

Un fármaco que se utiliza para tratar la diabetes ha demostrado mejorar el pronóstico de los pacientes con estenosis aórtica sometidos a intervención valvular cardiaca. El medicamento, dapagliflozina, redujo la tasa de muerte o de ingreso por insuficiencia cardiaca según los resultados de un ensayo clínico realizado en 1.250 pacientes coordinado por el CNIC en colaboración con el Hospital Álvaro Cunqueiro de Vigo. El estudio se publicó en la revista The New England Journal of Medicine.
La estenosis aórtica es una enfermedad degenerativa que progresa lentamente, reduciendo el orificio por el que la sangre es bombeada del corazón al resto del cuerpo. Como consecuencia, el músculo cardiaco debe esforzarse más, lo que puede derivar en insuficiencia cardiaca, angina de pecho o incluso muerte repentina por arritmias malignas.
El tratamiento de esta patología ha sido el reemplazo valvular mediante cirugía cardiaca. En los últimos años se ha desarrollado una técnica denominada TAVI (transcatheter aortic valve implantation), un procedimiento menos invasivo que permite implantar una nueva válvula a través de un cateterismo, evitando la cirugía mayor. Gracias a la TAVI, muchos pacientes de edad avanzada han visto prolongada su esperanza de vida. Sin embargo, estas personas siguen presentando un alto riesgo de insuficiencia cardiaca debido al desgaste sufrido por su corazón.
Hasta este estudio, no había ningún tratamiento que pudiese mejorar el pronóstico de pacientes añosos sometidos a TAVI.
Los inhibidores de SGLT2 (como dapagliflozina y empagliflozina) fueron desarrollados como antidiabéticos, pero su efectividad en insuficiencia cardiaca los ha convertido en un tratamiento clave para esta patología.
Sin embargo, a pesar de que los pacientes con estenosis aórtica desarrollan frecuentemente insuficiencia cardiaca, habitualmente han sido excluidos de los ensayos clínicos que mostraron el beneficio de los inhibidores de SGLT2.
DapaTAVI es un ensayo independiente, realizado en España sin financiación de la industria farmacéutica en 39 centros hospitalarios del territorio nacional, que incluyó a 1.250 pacientes con estenosis aórtica severa sometidos a TAVI y alto riesgo de insuficiencia cardiaca.
La mitad de los participantes recibió dapagliflozina tras el implante de TAVI, mientras que la otra recibió el tratamiento estándar. Tras un año de seguimiento, los resultados mostraron una reducción significativa en la mortalidad y en los ingresos hospitalarios por insuficiencia cardiaca en el grupo tratado con dapagliflozina.
Los investigadores señalan que DapaTAVI marca un hito en la investigación cardiovascular y podría cambiar el tratamiento de la estenosis aórtica en pacientes de edad avanzada en todo el mundo.
El estudio ha recibido financiación parcial del Instituto de Salud Carlos III, la Sociedad Española de Cardiología, la Sociedad Gallega de Cardiología y la Gerencia Regional de Salud de la Junta de Castilla y León.
Circulation
La “memoria” del corazón: explican cómo una lesión cardíaca de los padres puede afectar a su descendencia

El estrés en los primeros años de vida puede provocar efectos duraderos que persisten en la vida adulta. Sin embargo, se sabe menos sobre las posibles consecuencias heredadas para la siguiente generación. Investigadores del CNIC y de la Universidad de Berna (Suiza) han descubierto que una lesión cardíaca paterna provoca alteraciones en la función cardíaca de la descendencia. El estudio se publicó en la revista Circulation.
Se sabe que un historial familiar de infarto de miocardio influye en el riesgo de enfermedad cardiovascular. Dicho riesgo es mayor cuando el daño cardíaco en los padres ocurre a una edad más temprana. Cerca de 30.000 niños requieren cirugía cardíaca cada año en Europa. Por lo tanto, investigar la posibilidad de transmitir la “memoria” del daño cardíaco en la primera infancia a la siguiente generación permitiría avanzar en nuestra comprensión de las enfermedades cardiovasculares y mejorar la forma en que realizamos la anamnesis.
El estudio, el grupo de la investigadora del CNIC y la Universidad de Berna, Nadia Mercader, analizó en un modelo experimental si una lesión cardíaca podría también generar un efecto heredable.
Los resultados mostraron que la descendencia de los ratones que sufrieron un daño cardíaco presentó alteraciones en la función cardíaca. Además, la investigación muestra que los ratones también presentaron alteraciones en la respuesta al daño cardíaco, dependiendo de si su padre había sufrido una lesión o no.
En situaciones normales, explica la investigadora, después de un daño cardíaco, el corazón utiliza glucosa como fuente de energía en lugar de lípidos, lo que lleva a una acumulación de lípidos en el tejido cardíaco. “Curiosamente, la descendencia de padres lesionados acumuló menos lípidos en el tejido cardíaco después de la lesión cardíaca y se observó una mayor cantidad de lípidos en la circulación sanguínea. En conjunto, estas observaciones sugieren una recuperación metabólica mejorada después de la lesión cardíaca”.
En general, los cambios observados en la descendencia de padres lesionados indican que una intervención quirúrgica en el corazón realizada en las primeras etapas de la vida deja una “memoria” duradera que eventualmente puede transmitirse de una generación a otra.
Estos hallazgos abren el camino a una mejor comprensión de los impactos de las enfermedades cardíacas y resaltan la posible importancia de incluir el historial quirúrgico familiar al realizar la anamnesis del paciente.
Este proyecto ha recibido financiación del programa de investigación e innovación Horizonte 2020 de la Unión Europea -subvención No. 819719- y de una Beca Interdisciplinaria (UniBeAQ20 ID Grant) de la Universidad de Berna.
Circulation Research
Desarrollan una innovadora terapia génica para tratar una enfermedad genética del corazón rara y devastadora en hombres jóvenes

Un equipo del CNIC ha desarrollado una innovadora terapia génica que podría transformar el tratamiento de la miocardiopatía arritmogénica tipo 5 (ARVC5), una enfermedad genética cardiaca rara y extremadamente letal. Esta enfermedad, especialmente devastadora en hombres jóvenes, carece actualmente de cura, y los tratamientos disponibles solo ofrecen soluciones paliativas.
El estudio, dirigido por el Dr. Enrique Lara-Pezzi, líder del grupo Regulación Molecular de la Insuficiencia Cardiaca del CNIC e investigador del CIBERCV, demostró que la introducción de una versión sana del gen TMEM43 directamente en las células cardíacas mejora significativamente la función del corazón y prolonga la supervivencia de ratones afectados por la enfermedad.
La investigación es el resultado de una colaboración de más de 10 años de un equipo clínico, liderado por el Dr. Pablo García-Pavía, del Hospital Puerta de Hierro Majadahonda y jefe del grupo de Miocardiopatías Hereditarias del CNIC, y un grupo básico-traslacional, liderado por el Dr. Lara-Pezzi, que ha permitido comprender mejor esta enfermedad y ofrecer alternativas eficaces para su tratamiento.
Tras identificarse los primeros pacientes en España con esta enfermedad en el Hospital Puerta de Hierro, la colaboración de ambos grupos permitió en 2019 la creación del primer modelo que replicaba la enfermedad en animales. Ahora, los investigadores han ido un paso más allá desarrollando una terapia para tratar esta patología.
La ARVC5 está causada por mutaciones en el gen TMEM43 y se caracteriza por arritmias graves y muerte súbita. Es particularmente agresiva en varones jóvenes, cuya esperanza de vida media es inferior a los 42 años. Aunque los desfibriladores automáticos implantables (DAI) se utilizan para prevenir la muerte súbita, no existen tratamientos que frenen el avance de la enfermedad.
En este estudio los investigadores del CNIC han diseñado una terapia génica basada en vectores virales adenoasociados (AAV), una plataforma segura para su uso en humanos, con el fin de introducir una copia funcional del gen TMEM43 en las células cardíacas de ratones.
Los resultados obtenidos son prometedores: la terapia no solo mejoró la contracción del corazón y redujo la fibrosis, sino que también prolongó significativamente la vida de los ratones tratados. Una única dosis del tratamiento fue suficiente para prevenir las alteraciones eléctricas y estructurales típicas de la enfermedad.
El trabajo abre nuevas posibilidades terapéuticas para otras miocardiopatías hereditarias, un grupo de enfermedades para las que los tratamientos actuales contra la insuficiencia cardíaca a menudo resultan ineficaces.
Este estudio marca un paso clave en la búsqueda de tratamientos más efectivos para enfermedades raras y podría transformar el pronóstico de los pacientes afectados, aliviando la carga de las enfermedades cardíacas hereditarias y reduciendo la necesidad de un seguimiento médico constante, lo que beneficiaría tanto a los pacientes como a los sistemas de salud.
Este proyecto ha sido financiado por el programa Pathfinder Cardiogenomics program of the European Innovation Council (proyecto DCM-NEXT; 101115416) y por las subvenciones PID2021-124629OB-I00, TED2021-129774B-C22, PLEC2022-009235, otorgadas por el Ministerio de Ciencia e Innovación (MCIN/ AEI/10.13039/501100011033), por la Unión Europea a través de NextGenerationEU/PRTR (“Plan de Recuperación, Transformación y Resiliencia de España”) y por FEDER.
Nature Communications
Un tipo de células del sistema inmunitario potencia la inmunoterapia y previene la recaída del cáncer en modelos experimentales

Investigadores del CNIC en colaboración con el Instituto de Investigación Biomédica de Barcelona (IRB Barcelona) descubrieron una nueva estrategia de inmunoterapia que reduce la recurrencia del cáncer en modelos experimentales en ratón. El estudio, publicado en la revista Nature Communications, demuestra que un subtipo específico de células del sistema inmunitario, las células dendríticas de tipo I, es especialmente eficaz en activar una potente respuesta inmunitaria y generar memoria inmunitaria frente al cáncer.
Las células dendríticas actúan como centinelas del sistema inmunitario, siendo las encargadas de presentar los antígenos tumorales a los linfocitos T y desencadenar la respuesta contra las células malignas. Sin embargo, existen diversos subtipos de estas células dendríticas, y hasta ahora no se había determinado con precisión cuál de ellos es el más eficiente en generar una respuesta sostenida y protectora frente al tumor.
“El hallazgo es relevante porque la mayoría de las terapias actuales se centran en potenciar la inmunidad ya existente”, asegura Ignacio Heras-Murillo, investigador del CNIC y primer autor del trabajo. “En cambio, esta inmunoterapia con células dendríticas busca iniciar una nueva respuesta inmunitaria específica frente al tumor”.
La estrategia desarrollada consiste en extraer células dendríticas del paciente, cargarlas con antígenos derivados del tumor y reintroducirlas en el organismo para activar linfocitos T específicos. El estudio ha identificado que las células dendríticas de tipo I no solo desencadenan una respuesta efectora inmediata contra el tumor primario, sino que también inducen una memoria inmunitaria duradera que podría prevenir la reaparición tumoral.
David Sancho, director del proyecto en el CNIC, agrega que esta investigación muestra en ratones que la inmunoterapia con células dendríticas de tipo I que presentan el antígeno tumoral genera una respuesta de memoria inmunitaria que previene el crecimiento de un segundo tumor similar, es decir, que evita la recaída tumoral. Y agrega que para determinar su potencial en la prevención de metástasis y su posible sinergia con otros tratamientos de terapia antitumoral harán falta más estudios.
Este proyecto ha recibido financiación del CNIC; Ministerio de Ciencia, Innovación y Universidades (MICIU), Agencia Estatal de Investigación, Unión Europea NextGenerationEU/PRTR; la Fundación “la Caixa”; Comunidad de Madrid; Asociación Española Contra el Cáncer, y Worldwide Cancer Research (25-0080).
Developmental Cell
Revelan cómo se organiza el corazón desde las fases más tempranas del desarrollo embrionario

Un estudio publicado en la revista Developmental Cell desveló nuevos detalles sobre la formación del corazón en las primeras etapas del desarrollo embrionario. La investigación, llevada a cabo en el CNIC, demuestra que el corazón se origina a partir de dos poblaciones celulares distintas que se forman de forma independiente, pero coordinada, desde fases muy tempranas del desarrollo: concretamente justo cuando el embrión empieza a organizar sus capas celulares básicas, un proceso denominado gastrulación.
Este hallazgo tiene importantes implicaciones, destaca Miguel Torres, autor principal del estudio junto a Miquel Sendra. Por un lado, “permite entender mejor cómo se estructura el corazón en sus primeras fases, lo que podría ayudar a identificar el origen de algunas malformaciones cardíacas congénitas. Además, abre nuevas vías para la medicina regenerativa y la bioingeniería de tejidos”.
Hasta ahora se pensaba que tanto los cardiomiocitos como las células del endotelio endocárdico derivaban de un único grupo precursor.
Sin embargo, este trabajo, realizado mediante cultivo artificial de embriones de ratón y utilizando microscopía avanzada junto con técnicas de trazado celular, desvela que ambos tipos de células tienen orígenes diferentes dentro del mesodermo, una de las capas germinales del embrión.
A pesar de desarrollarse por separado, estas células entran al embrión de forma simultánea y migran de manera coordinada hacia la región donde comenzará a formarse el tubo cardíaco primitivo. Según los investigadores, este comportamiento sincronizado sugiere la existencia de mecanismos de organización muy precisos en fases en las que apenas se han formado estructuras visibles.
Además, los científicos observaron que estas células, aunque están destinadas a formar el corazón, también poseen la capacidad de contribuir al desarrollo de otros órganos, lo que refuerza su versatilidad y relevancia en la formación del organismo.
El estudio ha contado con financiación de la Fundación la Caixa (ID 100010434); Company of Biologists; la Agencia Estatal de Investigación; programa
H2020 de la Comisión Europea REANIMA, y CARDIOBOOST-CM de la Comunidad de Madrid.
Además, ha contado con el apoyo del FEDER “Una manera de hacer Europa” (infraestructura ReDIB ICTS TRIMA@CNIC, MCIN).Circulation Research
Descubren cómo la respuesta inmunitaria controla la aterosclerosis que provoca infartos e ictus

Un equipo del CNIC desveló el papel clave de las células dendríticas convencionales tipo 1 (cDC1) en la aterosclerosis y ha desarrollado una terapia experimental con nanopartículas inmunosupresoras que frena la progresión de la enfermedad en modelos animales. Publicado en Circulation Research, el estudio sienta las bases para futuras terapias inmunológicas personalizadas contra esta patología crónica.
La investigación del CNIC, desarrollada por el grupo de Inmunobiología del CNIC que lidera David Sancho, ha revelado que las células dendríticas convencionales tipo 1 (cDC1) desempeñan un papel crucial en este proceso inflamatorio. Los autores utilizaron modelos experimentales en ratones para analizar cómo la presencia o ausencia de estas células afecta al desarrollo de la aterosclerosis.
“Utilizamos ratones modificados genéticamente y alimentados con una dieta rica en colesterol, para simular las condiciones que favorecen la aparición de esta enfermedad”, explica Miguel Galán Burgos, autor principal del estudio. Al aumentar de forma artificial el número de cDC1 en estos animales, los investigadores observaron que las lesiones en las arterias se agravaban. Sin embargo, “cuando los ratones carecían específicamente de las cDC1, la formación de placas se reducía notablemente, incluso bajo una dieta poco saludable”, añade Galán Burgos.
Uno de los aspectos más innovadores de este trabajo ha sido el desarrollo de una terapia experimental basada en nanopartículas cargadas con un medicamento inmunosupresor, la dexametasona, y recubiertas por anticuerpos. Estas nanopartículas se desarrollaron en colaboración con Jesús Ruiz Cabello y Susana Carregal Romero, del grupo de investigación de Biomarcadores Moleculares y Funcionales del Centro de Investigación Cooperativa en Biomateriales (CIC biomaGUNE) de San Sebastián.
Las nanopartículas se diseñaron para dirigirse específicamente a las células dendríticas tipo 1 (cDC1). “Al administrar las nanopartículas en modelos animales de aterosclerosis, conseguimos reducir significativamente el tamaño de las lesiones en las arterias, así como la respuesta inflamatoria asociada a la enfermedad. Lo más destacado es que esta estrategia terapéutica permitió controlar la inflamación de las arterias sin comprometer la capacidad del organismo para defenderse de infecciones virales”, señalan los autores.
Este logro refuerza el papel de las cDC1 en la progresión de la aterosclerosis e introduce un enfoque prometedor para tratar esta enfermedad desde la raíz de su causa inmunitaria. Al dirigirse de manera precisa a las células inmunitarias implicadas, la terapia podría representar una alternativa más segura y eficaz que los tratamientos actuales, minimizando efectos secundarios sistémicos.
Este proyecto ha recibido financiación del Ministerio de Ciencia, Innovación y Universidades MICIU PID2022-137712OB-I00, PID2021-123238OB-I00, PID2022-139218OB-I00, CNS2023-143944, RYC2020-030241-I, PID2022-142842OB-I00, CPP2021-008310 and CPP2022-009762 financiado por la Agencia Estatal de Investigación, Unión Europea NextGeneration EU/PRTR; financiado también por la Comunidad de Madrid (P2022/BMD-7333 INMUNOVAR-CM) y por la Fundación “la Caixa” (LCF/PR/HR23/ 52430012 and LCF/PR/HR22/52420019).
Nature Biomedical Engineering
Descubren un método para estudiar proteínas mecánicas y su relación con enfermedades musculares

Un equipo del CNIC, liderado por Jorge Alegre-Cebollada, ha desarrollado un método innovador que permite estudiar de manera específica la función mecánica de las proteínas mediante su corte controlado, lo que hace que se bloquee su capacidad de sentir y transmitir fuerzas mecánicas, proporcionando nuevos conocimientos sobre el desarrollo de enfermedades musculares.
Los resultados de este estudio, publicados en la revista Nature Biomedical Engineering, han demostrado que la interrupción de la transmisión mecánica de la proteína titina desencadena patologías musculares. Este hallazgo abre nuevas perspectivas para comprender mejor enfermedades como las distrofias musculares y otras enfermedades relacionadas con la proteína titina.
Titina es la proteína más grande de los animales y desempeña un papel crucial como sostén de los sarcómeros, las unidades de contracción de las células musculares. Se ha demostrado que mutaciones en el gen de la titina (TTN) son una de las principales causas de diversas enfermedades musculares congénitas y cardiomiopatías, señala el Dr. Roberto Silva-Rojas, autor principal del trabajo.
El equipo del CNIC ha logrado, mediante el corte controlado de titina, replicar la falta de cohesión de los sarcómeros observada en pacientes con mutaciones en esta proteína. Los músculos con titina cortada muestran defectos estructurales similares a los observados en pacientes, como la reducción del tamaño celular, la internalización de los núcleos, la agregación de mitocondrias y la fibrosis intersticial.
“En ausencia de modelos de enfermedad con mutaciones de truncamiento de titina, el nuestro nos permite analizar de forma regulada y aguda el impacto de estas alteraciones. Esto lo convierte en una herramienta ideal para testar terapias dirigidas a mitigar los efectos de la pérdida de adhesión sarcomérica”, señala el Dr. Silva-Rojas.
Un hallazgo intrigante del estudio es que, en pocos días, el corte de titina provoca un colapso total de los sarcómeros, dejando a las células musculares sin su unidad funcional básica. Sin embargo, estas células no mueren, lo que sugiere que fenómenos similares podrían ocurrir en situaciones como roturas musculares, insuficiencia cardíaca o cardiotoxicidad inducida por quimioterapia, explican los autores del estudio.
Los investigadores subrayan que la metodología desarrollada en el CNIC supone un hito en el estudio de la contribución mecánica de las proteínas a la fisiología de los tejidos y órganos. Al igual que la proteína titina es fundamental para la transmisión de fuerza en los sarcómeros, otras proteínas como la distrofina, los distroglicanos, las integrinas o la lamina desempeñan funciones clave en la matriz extracelular y la integridad de las membranas celulares.
Gracias a esta nueva herramienta, los investigadores podrán confirmar o refutar hipótesis sobre el funcionamiento de estas proteínas, lo que podría allanar el camino hacia el desarrollo de nuevas estrategias terapéuticas para muchas enfermedades además de las musculares.
Este estudio ha sido financiado principalmente por el European Resarch Council (ERC) a través del Consolidator Grant ProtMechanics-Life (101002927) y la financiación postdoctoral de la European Molecular Biology Organization (EMBO) obtenida por el Dr. Silva-Rojas (EMBO ALTF 417-2022).













