Nature Communications: Identifican cómo las células madre se regulan a sí mismas y a su entorno
Un estudio realizado por investigadores del CNIC ha identificado un nuevo mecanismo a través del cual las células troncales de la sangre controlan tanto su propia proliferación como las características del nicho que las alberga.
La responsable de este control es la proteína E-Selectin Ligand-1 (ESL-1). Los autores de este trabajo, liderado por el Dr. Andrés Hidalgo y la Dra. Magdalena Leiva, han visto que dicha proteína se expresa en grandes cantidades en estas células madre y han podido ver que también controla la producción de la citoquina TGF-ß de dichas células.
Según los investigadores, esto es importante porque TGF-ß, un tipo de proteína, tiene propiedades anti-proliferativas y es fundamental para impedir la desaparición de estas células madre en algunos procesos patológicos, como ocurre en determinados tipos de anemia.
Además los investigadores han comprobado que las células deficientes para la proteína ESL-1 son resistentes a distintos tipos de agentes citotóxicos o quimioterápicos. Estos resultados sugieren que la proteína ESL-1 puede convertirse en una diana terapéutica para las terapias dirigidas a mejorar la regeneración de la médula durante la quimioterapia o para la expansión de las células madre de la sangre para su posterior donación. El estudio se publica en la revista Nature Communications.
Las células de la sangre tienen un origen común: las células madre hematopoyéticas. Dichas células, aseguran los investigadores, “tienen la capacidad de auto-renovarse y fabricar copias de sí mismas, además de producir las células de la sangre a lo largo de la vida: tanto los glóbulos rojos, responsables de transportar el oxígeno a todos los tejidos, como todo tipo de glóbulos blancos, imprescindibles para el funcionamiento del sistema inmune”.
Una característica fundamental de las células madre es la quiescencia o capacidad de permanecer en reposo sin dividirse, ya que previene su agotamiento y asegura su mantenimiento en situaciones patológicas, como ante la demanda aguda de producción de células sanguíneas o la presencia de agentes dañinos al ADN, como son muchos agentes quimioterápicos.
La mayoría de estas células troncales se encuentran en la médula ósea, en el interior de los huesos. Allí, afirma el Dr. Hidalgo, residen en un “microambiente” o nicho que proporciona los “elementos necesarios para su mantenimiento óptimo”. Así, añade este investigador, cualquier perturbación de este nicho hace peligrar de forma directa la funcionalidad de estas células, lo que puede traducirse en enfermedades como leucemias o aplasias. Sin embargo, “todavía falta por identificar muchos de los mecanismos y componentes celulares de este microambiente medular, algo que resulta de vital importancia por las posible implicaciones terapéuticas que tiene”.
Además de haber identificado este nuevo mecanismo a través del cual las células troncales de la sangre controlan tanto su propia proliferación como las características del nicho que las alberga, los autores del estudio han descrito por primera vez cómo esta proteína afecta de manera local a distintas poblaciones del microambiente medular, incluyéndose otras células troncales vecinas.
Este hallazgo, destacan, abre la puerta al desarrollo de “nuevas terapias con células madre modificadas genéticamente frente a determinadas enfermedades hematológicas, como ciertos tipos de leucemia, en las que el nicho hematopoyético y las células madre hematopoyéticas están muy afectadas”, afirma la Dra. Leiva.
Para identificar esta nueva ruta, los investigadores han analizado la médula ósea de animales deficientes en esta proteína. Así han podido observar que en su ausencia, las células troncales de la sangre proliferan menos y, por tanto, son de mayor calidad para su empleo en una posible terapia. “Hemos visto que estas células son resistentes a procesos de daño medular como la mortalidad celular originada por agentes citotóxicos”, comenta la Dra. Leiva.
De hecho, uno de los hallazgos más relevantes de este artículo es el incremento de la resistencia de éstas células deficientes para la proteína ESL-1 a distintos tipos de agentes citotóxicos o quimioterápicos. Estos resultados señalan a la proteína ESL-1 como una posible “diana terapéutica para mejorar la regeneración de la médula durante el tratamiento con quimioterapia”.
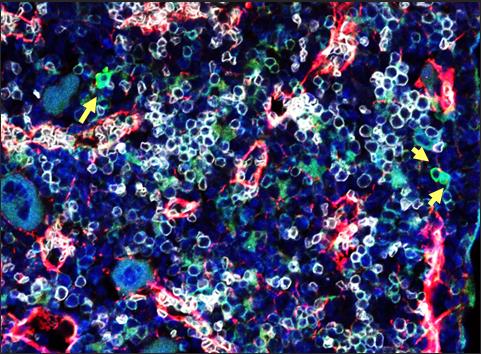
Figura 1. Imagen de microscopia de fluorescencia de la médula ósea de un ratón. Las flechas señalan las células troncales hematopoyéticas.
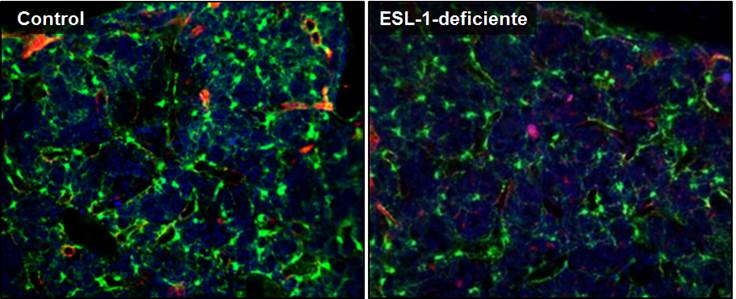
Figura 2. Imágenes de microscopia de fluorescencia de las médulas óseas de ratones reporteros para la citoquina de nicho CXCL12 trasplantados con médula ósea control (izquierda) o ESL-1-deficiente (derecha). El verde (señal GFP) identifica a las células productoras de CXCL12.











