Science: Descubierto un nuevo mecanismo de defensa celular frente a infecciones víricas y bacterianas
Un estudio del CNIC, IDIBAPS y la UB describe un nuevo mecanismo de defensa inmunológica desconocido hasta ahora. Se trata de un mecanismo orquestado por los cuerpos lipídicos (CLs)
Un estudio publicado en la revista Science en el que han participado investigadores del CNIC, IDIBAPS y la UB describe un nuevo mecanismo de defensa inmunológica desconocido hasta ahora. Se trata de un mecanismo orquestado por los cuerpos lipídicos (CLs); orgánulos celulares capaces de atraer y eliminar a los patógenos invasores.
El estudio lo han coordinado Albert Pol, profesor ICREA en el IDIBAPS donde dirige el equipo Tráfico de lípidos y enfermedades y profesor asociado de la Facultad de Medicina de la UB, y Robert G. Parton, del Instituto de Biociencias Moleculares de la Universidad de Queensland. Los primeros autores del trabajo son Marta Bosch, investigadora del grupo IDIBAPS, y Miguel Sánchez-Álvarez, del grupo de Mecanoadaptación y Biología de Caveolas del CNIC.
Los investigadores de CNIC Miguel Ángel del Pozo (Grupo de Mecanoadaptación y Biología de Caveolas) y Juan Antonio López, Rocío Campo y Jesús Vázquez (Grupo de Proteómica Cardiovascular), han participado en esta investigación.
Los CLs son los orgánulos donde nuestras células acumulan nutrientes que, en forma de grasa, proporcionan la energía necesaria para que puedan desarrollar su función. Por ejemplo, los CLs proporcionan la energía para que el corazón pueda latir, que el hígado haga su función metabólica, o que el músculo haga su movimiento. “El cuerpo lipídico es como la despensa de nuestras células, donde acumulamos el alimento que utilizaremos más adelante. Esto sucede en todas las células eucariotas, desde las levaduras o los insectos hasta las plantas o los mamíferos”, señala Albert Pol.
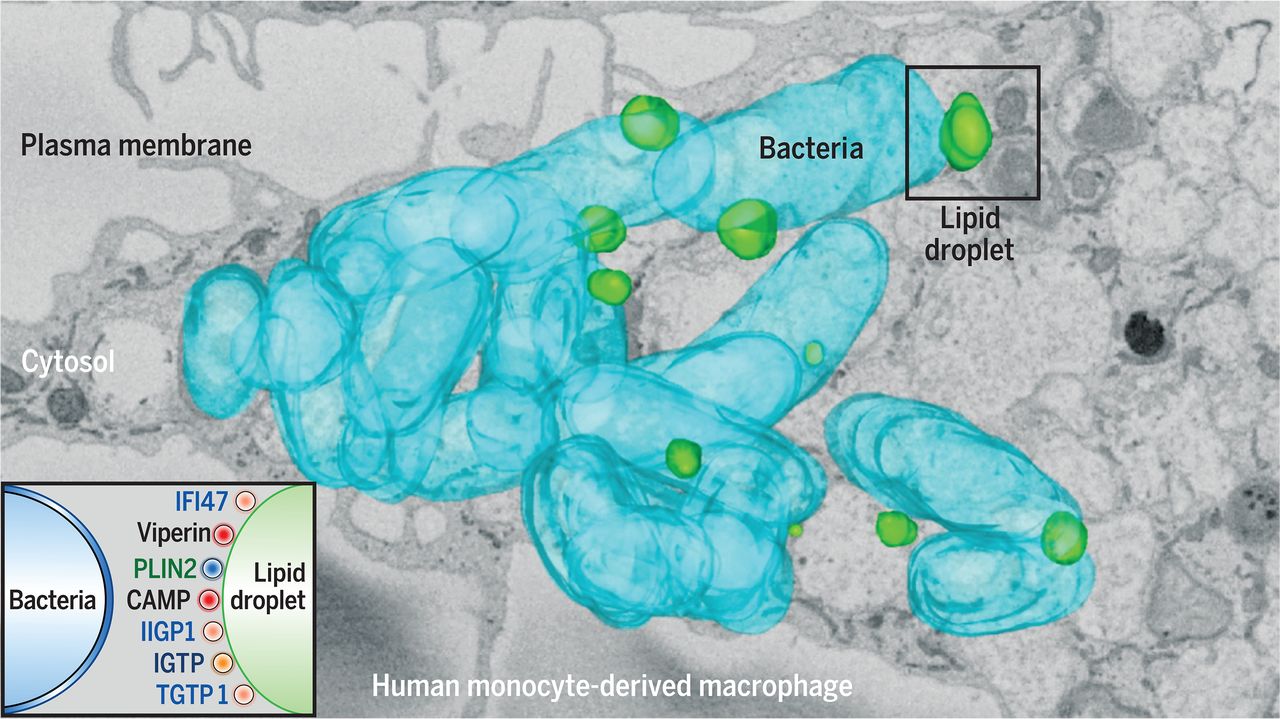
Cuando los virus o las bacterias infectan la célula huésped necesitan gran cantidad de nutrientes para multiplicarse y para conseguirlos se dirigen al CL. En el estudio publicado en Science los investigadores han demostrado que, en respuesta a la infección, los CLs organizan complejos de proteínas antibióticas y antivirales que actúan de forma cooperativa para combatir al patógeno y eliminarlo. Se trata de un mecanismo que funcionaría en todas las células del cuerpo, no sólo en células profesionales del sistema inmunológico como los macrófagos. Esta estrategia de defensa también ha sido observada en insectos, sugiriendo su importancia durante la evolución de nuestra inmunidad innata.
El cuerpo lipídico es como la despensa de nuestras células, donde acumulamos el alimento que utilizaremos más adelante. Esto sucede en todas las células eucariotas, desde las levaduras o los insectos hasta las plantas o los mamíferos
Los investigadores han demostrado que, para protegerse de la infección, las células colocan gran cantidad de proteínas antibióticas y antivirales en los CLs. En total, comparando la superficie del CL en células normales y en células infectadas, el estudio ha identificado 400 candidatos que realizarían la función de protección de los CLs cuando entran en contacto con el patógeno. “En este estudio nos hemos centrado en seis de estas proteínas y hemos demostrado que realmente protegen durante la infección de diferentes tipos de bacterias” explica Marta Bosch.
“Estos complejos incluyen péptidos antimicrobianos como viperin o catelicidina, que contribuyen a conferir a las CLs la capacidad de matar bacterias que han penetrado en la célula”, asegura Miguel Sánchez, co-primer autor del estudio.
Esta misma respuesta además simultáneamente desconecta a los CLs de otras estructuras de la célula, como las mitocondrias, con las que normalmente se comunican para la utilización de la energía que almacenan. “Esto permite la utilización ´segura´ por parte de la célula de esas proteínas defensivas precisamente en el lugar al que numerosos patógenos intentan llegar, minimizando al mismo tiempo el riesgo de dañar estructuras propias” comenta Miguel Ángel del Pozo, que añade que “en el caso de las mitocondrias esto es particularmente relevante, al ser estructuras que guardan una notable similitud evolutiva con organismos procariotas”.
Estos complejos incluyen péptidos antimicrobianos como viperin o catelicidina, que contribuyen a conferir a las CLs la capacidad de matar bacterias que han penetrado en la célula
Los niveles de una proteína clave en la comunicación entre CLs y mitocondrias, perilipin-5, son reducidos en los CLs del hígado de animales expuestos a lipopolisacárido bacteriano, favoreciendo glicólisis aeróbica frente a fosforilación oxidativa. “Este mecanismo podría coordinar el aumento de actividad bactericida con una reprogramación metabólica adecuada al estado defensivo inducido en el organismo”, apunta Miguel Sánchez.
Esta nueva forma de defensa destaca la íntima relación emergente entre metabolismo e inmunidad, y puede conducir a nuevas estrategias terapéuticas en un momento especialmente crítico, en el que la resistencia a antibióticos constituye un desafío de salud pública mundial creciente.
“La concentración de estas proteínas antibióticas y antivirales en un único compartimento del interior de la célula permite crear sinergias a la vez que reducir su toxicidad y que el resto de la maquinaria celular funcione con normalidad”, señala Miguel Sánchez-Álvarez.
Además, el estudio demuestra que esta estrategia permite una respuesta de amplio espectro, es decir, hay un gran número de antibióticos y antivirales con diferentes mecanismos de acción. también permite generar mecanismos cooperativos para atacar la infección. “Se establecen sinergias entre las proteínas para, por ejemplo, una romper la membrana del patógeno y la otra destruir su material genómico”, explican los autores.
Este estudio supone un cambio de paradigma, pues hasta ahora se pensaba que los CLs estaban al servicio de los virus o bacterias durante la infección
“Este estudio supone un cambio de paradigma, pues hasta ahora se pensaba que los CLs estaban al servicio de los virus o bacterias durante la infección”, señala Albert Pol. “En vista de la resistencia generalizada a los antibióticos actuales, este estudio ha descifrado un importante mecanismo de defensa que podría aprovecharse para el desarrollo de nuevas estrategias terapéuticas para frenar las infecciones”, concluye.
En el proyecto internacional, financiado por la Human Frontier Science Program, han participado investigadores de España, Estados Unidos, Australia y Brasil.