Cell Genomics: Revelan cómo ha evolucionado el sistema energético de las células y cómo puede ayudar a entender las enfermedades genéticas
Investigadores del CNIC descubren las claves evolutivas del sistema OxPhos, el "motor" de la célula, y desarrollan una herramienta para detectar mutaciones que causan enfermedades mitocondriales.
Las mitocondrias son las “fábricas de energía” de nuestro organismo y su funcionamiento correcto es vital para producir la energía que necesitamos. En su interior funciona el sistema de fosforilación oxidativa, OxPhos, un conjunto de proteínas que trabaja como una cadena para transformar el oxígeno y los nutrientes en energía.
Ahora, el estudio, liderado por el grupo GENOXPHOS del Centro Nacional de Investigaciones Cardiovasculares (CNIC) y del Centro de Investigación Biomédica en Red Fragilidad y Envejecimiento Saludable (CIBERFES), y dirigido por el Dr. José Antonio Enríquez, desvela cómo ha evolucionado este sistema a lo largo de millones de años, desde los primeros vertebrados hasta los seres humanos. “Comprender esta evolución ayuda a explicar por qué algunas mutaciones genéticas provocan enfermedades raras y graves que afectan a este sistema”, señala el Dr. José Luis Cabrera, autor principal del artículo cuya investigación cuenta con el apoyo de la Fundación ‘la Caixa’.
El estudio, publicado en la revista Cell Genomics, desvela las estrategias evolutivas a nivel molecular que ha seguido el principal centro de integración metabólico y energético de la célula, el sistema OxPhos, y describe como esta información puede ser utilizada para identificar en personas mutaciones causantes de enfermedades.
Los investigadores, en colaboración con el grupo de Fátima Sánchez-Cabo, jefa del grupo de Biomedicina de Sistemas Computacional del CNIC, han analizado cómo interactúan los dos tipos de ADN que codifican las proteínas del sistema OxPhos: el ADN nuclear (heredado del padre y la madre) y el ADN mitocondrial (que solo se hereda de la madre).
El sistema OxPhos, explica el Dr. Enríquez, jefe del grupo Genética Funcional del Sistema de Fosforilación Oxidativa (GENOXPHOS) del CNIC, está formado por cinco grandes bloques de proteínas: cuatro que transportan electrones y otro, llamado ATP-sintetasa, que produce energía en forma de ATP, el "combustible" celular.
“Estos bloques pueden funcionar por separado o formar grupos según lo que necesite la célula. En total, están formados por unas 103 proteínas, codificadas por dos tipos de ADN: el nuclear y el mitocondrial. Y, mientras que el ADN nuclear cambia poco con el tiempo y gana variedad gracias a la mezcla genética durante la reproducción, el ADN mitocondrial se modifica mucho más rápido, aunque solo se transmite de madres a hijos”, aclara el Dr. Enríquez.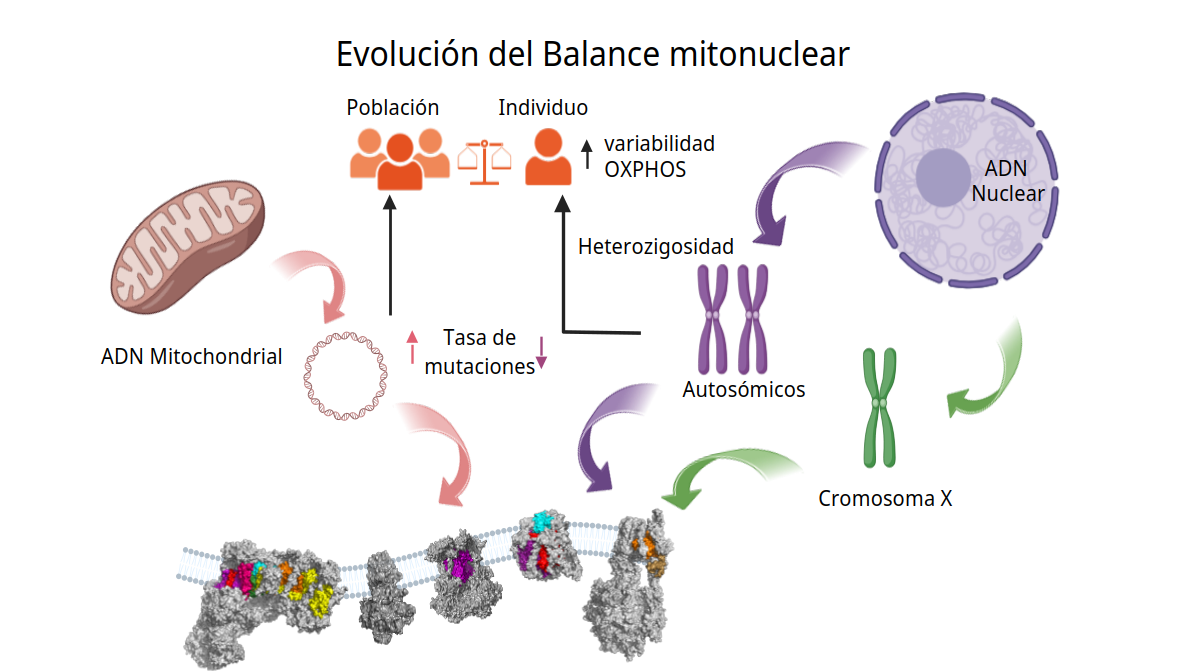
Añade el Dr. Cabrera que las proteínas codificadas por el ADN mitocondrial constituyen el corazón de los complejos respiratorios, “cuyo correcto funcionamiento depende de que los componentes nucleares y los mitocondriales encajen adecuadamente”.
Además, el estudio presenta una herramienta innovadora: ConScore, un índice de predicción funcional que permite evaluar la relevancia clínica de las mutaciones en las 103 proteínas que componen el sistema OxPhos. “Este índice se basa en la divergencia evolutiva de estas proteínas entre vertebrados —incluidos mamíferos y primates—, y complementa los estudios de variabilidad genética en poblaciones humanas”, señala el Dr. Enríquez.
ConScore ofrece un nuevo marco para interpretar mutaciones potencialmente patológicas, abriendo la puerta al desarrollo de mejores estrategias diagnósticas y terapéuticas frente a enfermedades mitocondriales, aseguran los investigadores.
Esta investigación, concluyen sus autores, no solo ayuda a entender cómo hemos evolucionado a nivel celular, sino que también acerca nuevas soluciones para mejorar la salud de las personas que sufren enfermedades genéticas raras.
El estudio ha recibido financiación de la Unión Europea «NextGenerationEU»/Plan de Recuperación, Transformación y Resiliencia/PRTR, CIBERFES; Fundación ‘la Caixa’, Human Frontier Science Fundation; beca Severo Ochoa concedida por MICIU/AEI y por los Fondos Sociales Europeos (FSE invierte en tu futuro).











