Circulation Research: Desvelado un mecanismo que regula la hipertrofia cardiaca
Los hallazgos pueden ayudar a desarrollar nuevas herramientas terapéuticas para el tratamiento de la hipertrofia cardíaca
Investigadores del Centro Nacional de Investigaciones Cardiovasculares (CNIC) han identificado un nuevo mecanismo de regulación de la hipertrofia cardiaca, una enfermedad sobre la que todavía hoy día se desconocen en profundidad los mecanismos que la controlan, lo que impide el desarrollo de terapias efectivas.
Los hallazgos, que se publican en Circulation Research, pueden ayudar a desarrollar nuevas herramientas terapéuticas para el tratamiento de la hipertrofia cardíaca y especialmente para los pacientes con síndrome de Cushing con hipertrofia cardiaca.
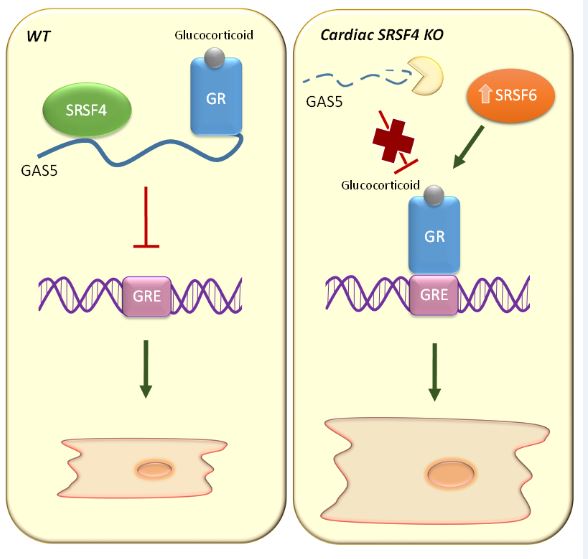
Los resultados, explica el Dr. Enrique Lara Pezzi, líder del estudio y jefe del Laboratorio de Regulación Molecular de la Insuficiencia Cardiaca del CNIC, desvelan que la “proteína SRSF4 se une y estabiliza el ARN no codificante GAS5, que a su vez inhibe el receptor de glucocorticoides y previene así la hipertrofia cardiaca”.
Los cardiomiocitos son las células responsables de la contracción del corazón. A pesar de que los cardiomiocitos apenas se pueden dividir en el órgano adulto, muestran una gran capacidad de adaptación a las demandas de contracción del organismo, explica el Dr. Lara Pezzi.
Un ejemplo de esta capacidad de adaptación es la respuesta a la estenosis aórtica. “Cuando la válvula aórtica no puede abrirse completamente (estenosis) -explica el Dr. Lara Pezz-i, se produce un estrechamiento del orificio por el que el ventrículo izquierdo debe propulsar la sangre hacia el organismo, lo que exige al corazón realizar un esfuerzo mayor en la contracción”.
La hipertrofia cardiaca es una enfermedad sobre la que todavía hoy día se desconocen en profundidad los mecanismos que la controlan, lo que impide el desarrollo de terapias efectivas
Y añade que como los cardiomiocitos no se pueden dividir, “para aumentar la capacidad contráctil del corazón estas células deben acrecentar su tamaño, lo que se conoce como hipertrofia”.
Pero, aunque inicialmente esta respuesta resulta eficaz, el engrosamiento de las paredes del ventrículo izquierdo (hipertrofia cardiaca) provoca cambios estructurales en el corazón, que progresivamente causan una pérdida de capacidad contráctil.
El grupo del Dr. Lara-Pezzi, en colaboración con investigadores del Hospital Puerta de Hierro de Majadahonda, el Centro de Investigación Biomédica en Red Cardiovascular (CIBERCV) y la Universidad de Frankfurt (Alemania), ha analizado los nuevos mecanismos responsables del desarrollo de esta patología.
Los investigadores han visto que los ratones que carecían de SRSF4, una proteína que se une al ARN, desarrollaban hipertrofia cardiaca y presentaban problemas de relajación del músculo cardiaco (disfunción diastólica).
Al analizar los posibles mecanismos moleculares implicados en esta respuesta, el equipo del CNIC encontró que la ausencia de SRSF4 reduce enormemente la expresión de un ARN no codificante llamado GAS5. “La proteína SRSF4 se une directamente a GAS5 y evita que se degrade dentro de la célula. GAS5 a su vez es un inhibidor del receptor de glucocorticoides, cuya activación puede contribuir al desarrollo de hipertrofia cardiaca”, aclara el Dr. Lara Pezzi.
Tal y como explica el Dr. Javier Larrasa, primer autor del estudio, “la ausencia de SRSF4 provocaba la degradación de GAS5 y, a su vez, la activación del receptor de glucocorticoides, mientras que la sobrexpresión de GAS5 utilizando un vector viral permitió no solo inhibir el receptor de glucocorticoides sino también reducir la hipertrofia del corazón”.
Los investigadores concluyen que la identificación del eje de señalización celular SRSF4-GAS5-receptor de glucocorticoides supone un importante avance en la caracterización de los mecanismos moleculares que controlan la hipertrofia cardiaca y podría ser la base de nuevas terapias.
La identificación del eje de señalización celular SRSF4-GAS5-receptor de glucocorticoides supone un importante avance en la caracterización de los mecanismos moleculares que controlan la hipertrofia cardiaca y podría ser la base de nuevas terapias
Los resultados, añaden, podrían ser “particularmente relevantes para pacientes con síndrome de Cushing, que presentan hipertrofia cardiaca causada en parte por activación del receptor de glucocorticoides”.
Los investigadores observaron una cierta desregulación de la expresión de SRSF4 y GAS5 en muestras de estos pacientes, aunque su posible papel en este síndrome requerirá investigación adicional.
El estudio ha contado con la ayuda de la Unión Europea (CardioNeT-ITN-289600 y CardioNext-ITN-608027), del Ministerio de Economía y Competitividad, de la Comunidad de Madrid (2010-BMD-2321 “Fibroteam”). También del Plan Estatal de I+D+I 2013-2016 y la iniciativa “A way to build Europe” de la European Regional Development Fund (ERDF).











