Nature Cardiovascular Research: Un equipo del CNIC crea un atlas dinámico en 3D de la formación del corazón embrionario
El estudio que se publica hoy en Nature Cardiovascular Research aporta información relevante sobre el desarrollo de las malformaciones cardíacas
Investigadores del Centro Nacional de Investigaciones Cardiovasculares (CNIC) han creado un atlas 3D del proceso de formación del corazón en su fase embrionaria, a partir de una colección de muestras de ratón. El atlas 3D ha permitido identificar el inicio de la asimetría izquierda-derecha del corazón, según se detalla en un estudio que se publica hoy en Nature Cardiovascular Research, que aporta información relevante sobre el desarrollo de las malformaciones cardíacas.
La investigación, señala el Dr. Miguel Torres, jefe del grupo Control Genético del Desarrollo y Regeneración de Órganos del CNIC y director del estudio que se publica en Nature Cardiovascular Research, “será de gran ayuda para comprender el desarrollo del corazón”.
Una pregunta fundamental en Biología del Desarrollo es cómo adquieren los tejidos sus formas complejas a partir de geometrías simples, un proceso llamado morfogénesis. Esta tarea es relativamente accesible para los órganos que se desarrollan siguiendo un patrón muy reproducible, como en las extremidades o los ojos, y se pueden visualizar fácilmente; sin embargo, es más difícil en órganos como el corazón de los mamíferos, con una variabilidad morfológica extrema y poco accesibles a la videomicroscopía, señalan los investigadores del CNIC.

Durante la cardiogénesis temprana no hay dos corazones embrionarios que se parezcan mucho, hasta el punto de ser tan diferentes que es difícil decidir cuál se encuentra en una etapa de desarrollo más avanzada. Sin embargo, asegura el Dr. Torres, “las primeras morfologías aparentemente divergentes convergen más tarde para producir un corazón típico de recién nacido”.
El desafío es capturar la evolución promedio de la geometría del tejido cardíaco a partir de su amplia gama de variabilidad natural y poder discriminar entre variaciones morfológicas fisiológicas y anormales de entre una muestra lo suficientemente grande.
“Solo entonces seríamos capaces de comprender las propiedades de la morfogénesis fisiológica e identificar cuándo y cómo ocurren las anomalías”, explica el Dr. Torres.
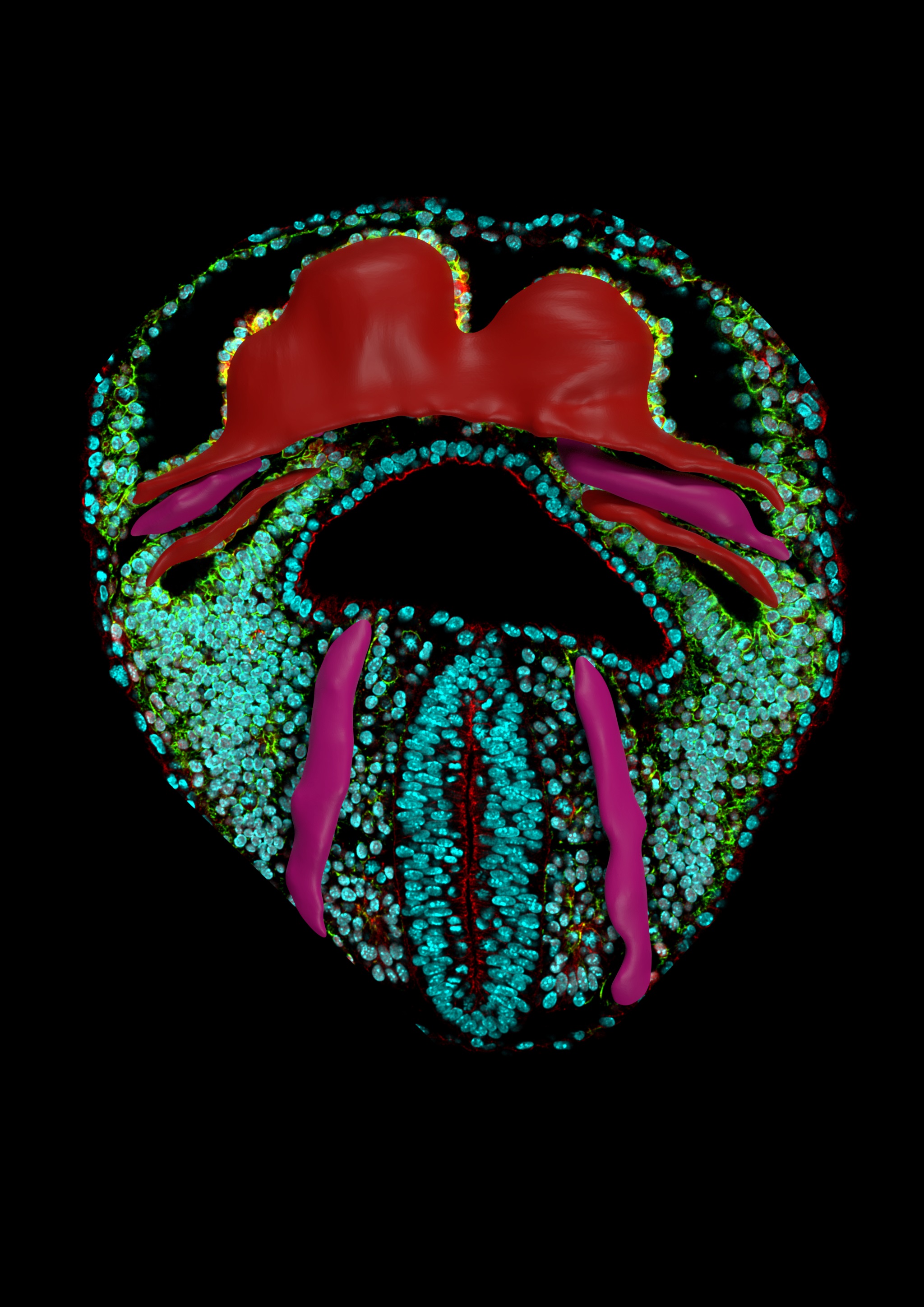
Para superar las limitaciones a la hora de obtener imágenes en vivo, el equipo del CNIC adquirió imágenes de alta resolución de una colección amplia de corazones embrionarios de ratón recogidos durante etapas clave de su desarrollo y con una alta densidad temporal.
“Nos dimos cuenta de que la morfogénesis del corazón no podía aislarse de la de los tejidos circundantes, ya que la formación del tubo cardíaco se asemeja a un pliegue geológico producido en una capa continua del mesodermo -capa celular que constituye el embrión- de la cavidad pericárdica”, explica el Dr. Torres. Por lo tanto, añade el primer autor del estudio, Isaac Esteban, “capturamos todos los tejidos de la cavidad pericárdica y el endodermo del intestino anterior subyacente”.
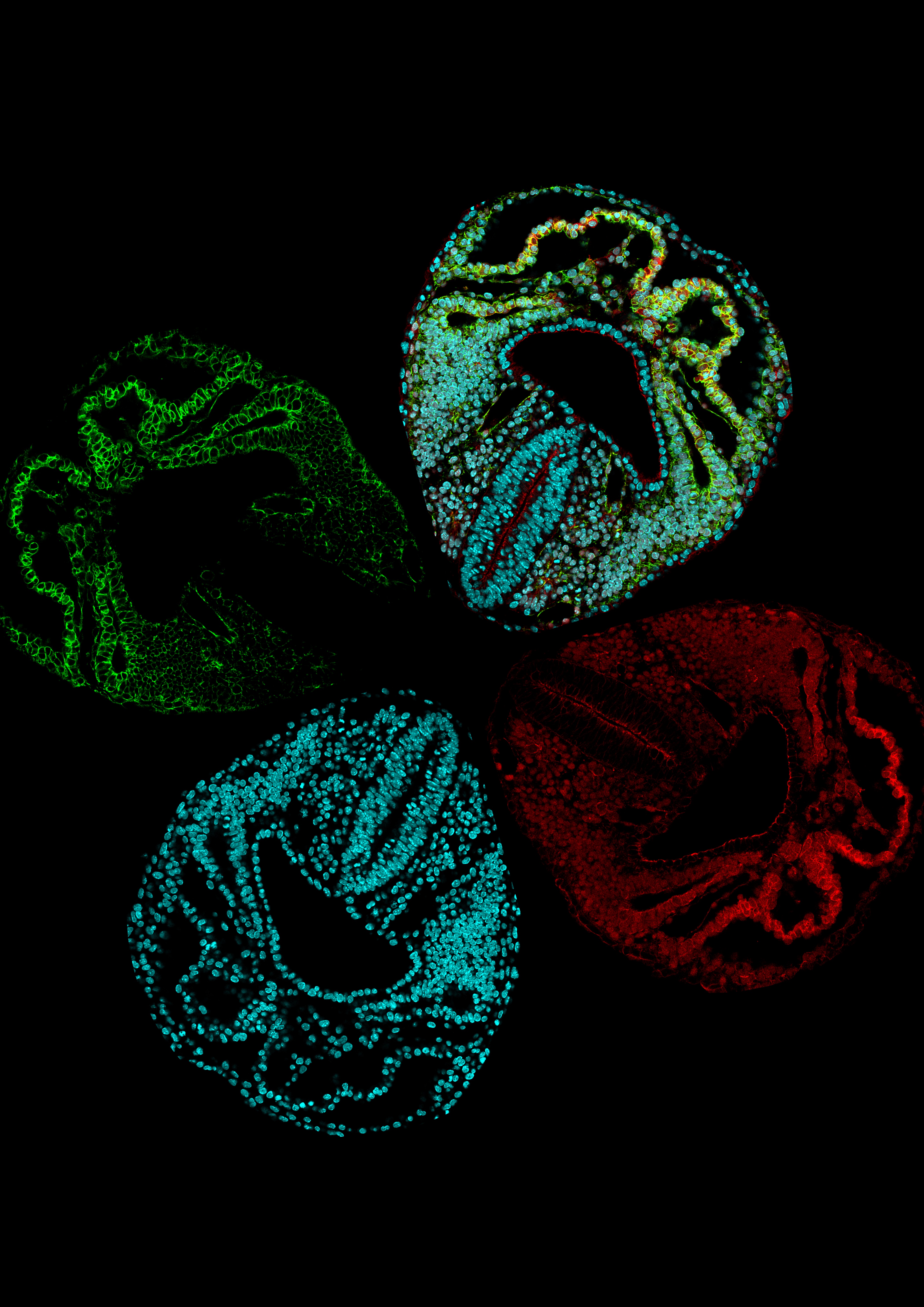
Posteriormente, los investigadores transformaron las imágenes en versiones digitales y, gracias a un sistema de estadiaje morfométrico, las ordenaron temporalmente, ya que el momento de la obtención de embriones no se corresponde necesariamente con el tiempo de desarrollo morfológico real.
Los científicos del CNIC han empleado un enfoque desarrollado recientemente: el mapeo entre superficies, que genera mapas de puntos correspondientes entre formas similares con una densidad de puntos suficiente para reconstruir toda la superficie de los objetos.
“Este método permitió identificar posiciones equivalentes entre grupos de especímenes en una etapa similar y en etapas de desarrollo consecutivas”, explica Esteban. Así crearon un atlas temporal en 3D que muestra la trayectoria de la formación del tubo cardíaco y la variabilidad morfológica local en cada etapa.
La información obtenida muestra que las regiones habitualmente involucradas en malformaciones cardíacas coincidían con regiones de alta heterogeneidad morfológica y/o alta variabilidad en el tiempo de desarrollo. “Esta observación sugiere que la variabilidad morfológica puede ser la base de la alta incidencia natural de malformaciones congénitas cardíacas, que afectan al 1% de los nacidos vivos”, asegura Esteban.
Además, la metodología generada se puede aplicar al análisis cuantitativo de la morfogénesis de cualquier órgano u organoide (versión “in vitro” de un órgano en desarrollo).
Si una imagen vale más que mil palabras, “Una película proporciona mucha más información que mil imágenes aisladas”, señala el Dr. Torres, por lo que considera que “el atlas dinámico generado y el sistema de estadificación morfométrico descrito serán de gran ayuda y una fuente de inspiración para los científicos interesados en comprender el desarrollo del corazón”.
La principal limitación del estudio es el uso de imágenes fijas para reconstruir un proceso dinámico, lo cual no permite analizar las bases celulares de la deformación de los tejidos. El atlas generado, sin embargo, será una base imprescindible para contribuir a ese conocimiento y los científicos están ya trabajando en incorporar datos celulares este nuevo atlas dinámico del desarrollo del corazón.