Nature Immunology : Islas proteicas organizadas por la Caveolina-1 en los linfocitos B defienden al organismo
Un equipo internacional de investigadores de la Universidad de Friburgo y del CNIC descubren un mecanismo esencial para educar al sistema inmune y proteger nuestro organismo de enfermedades autoinmunes.
Nuestro sistema inmunológico nos protege de múltiples amenazas: cáncer, virus, bacterias y microbios que causan enfermedades (patógenos). Sin embargo, en ocasiones, se activa de manera incorrecta y ataca a nuestras propias células, desarrollando un grupo de patologías conocido como enfermedades autoinmunes. Tradicionalmente, la autoinmunidad se ha asociado con una hiperactividad del sistema inmune, y en consecuencia, su tratamiento se ha basado mayoritariamente en la inhibición farmacológica de las células del sistema inmune. Sin embargo, las observaciones clínicas más recientes sugieren que, por el contrario, en algunas ocasiones la autoinmunidad puede estar causada por una activación insuficiente de las células del sistema inmune. En estos casos, la estrategia de inhibición farmacológica puede ser contraproducente, y lo más adecuado sería aplicar estrategias de activación o sustitución. Inspirados en este nuevo concepto, investigadores de la Universidad de Friburgo (Alemania) y del Centro Nacional de Investigaciones Cardiovasculares Carlos III (CNIC, Madrid) han identificado una proteína, Caveolina-1, como regulador clave en un modelo único de autoinmunidad causada por el funcionamiento insuficiente del sistema inmune.
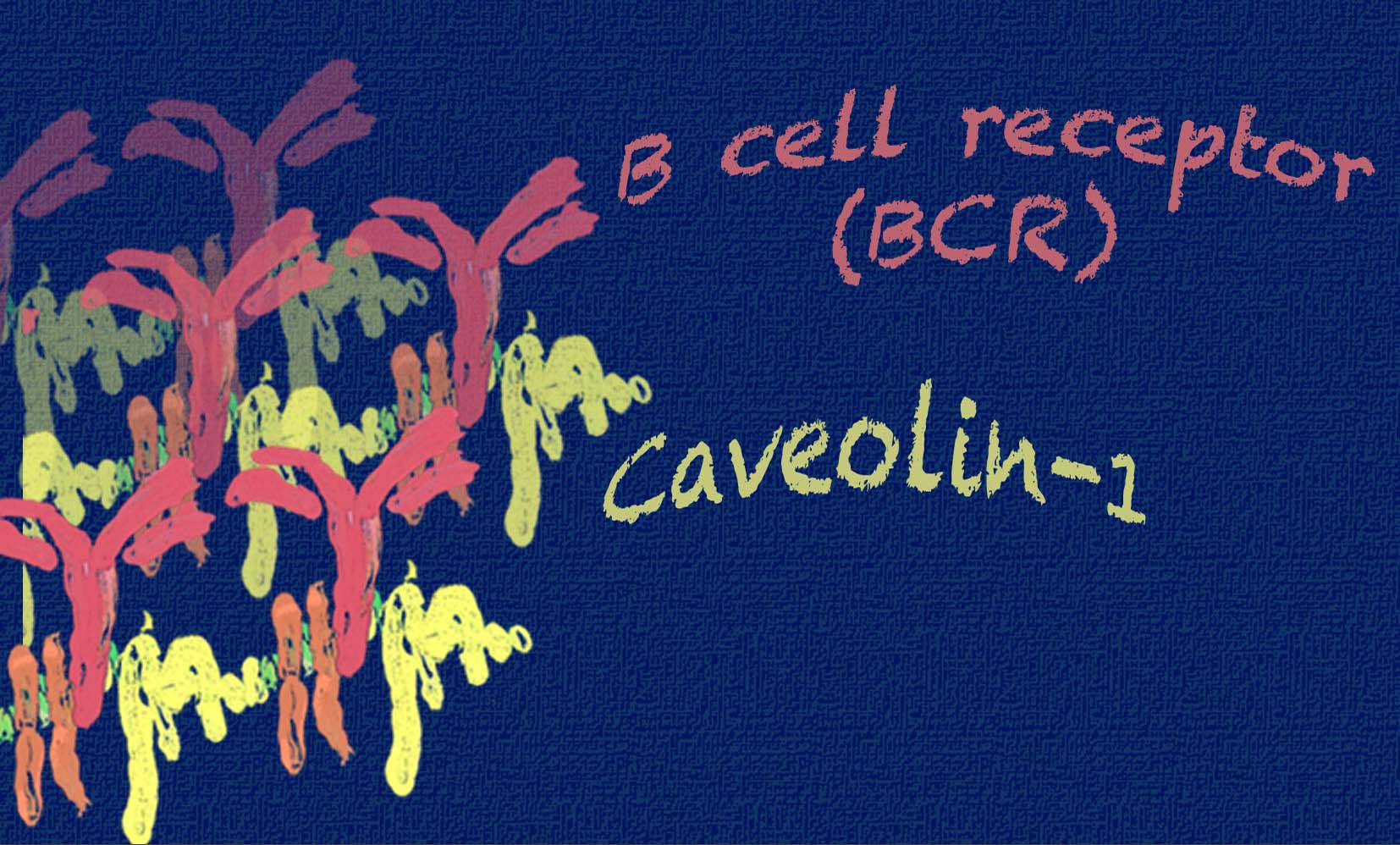
Los linfocitos B son células del sistema inmune que reconocen a los patógenos gracias a su receptor de membrana: el BCR (del inglés, B cell Receptor). El BCR actúa como una antena que reconoce patógenos, virus y bacterias, transmitiendo esas señales al interior del linfocito B, logrando así su activación. Estas señales activan la producción de anticuerpos y señales químicas que neutralizan la amenaza. Investigaciones de referencia de la Universidad de Friburgo y del Cancer Research Institute en Londres habían demostrado previamente que el BCR no está distribuido homogéneamente en la membrana celular sino que, por el contrario, estos receptores se agrupan en estructuras conocidas como islas proteicas (“protein islands”). Cuando los linfocitos B reconocen una amenaza, las propiedades de estas islas proteicas cambian, pero hasta ahora se desconocía si estos cambios eran necesarios para el funcionamiento de los linfocitos B.
Ahora, en el estudio publicado por la revista Nature Immunology, la Dra. Susana Minguet y sus colaboradores han demostrado que la proteína Caveolin-1 es la responsable de la organización de estos receptores en la membrana de los linfocitos B. Usando modelos experimentales, los autores han demostrado que en ausencia de Caveolina-1, los BCR están desorganizados y, lo más importante, no reconocen eficientemente las amenazas, activando las células B de forma deficiente y por tanto generando respuestas inmunes insuficientes. Estos resultados demuestran por primera vez que la organización de los receptores en la membrana de los linfocitos B garantiza la correcta activación de estas células.
'Tolerantes'
Los investigadores han visto, paradójicamente, que los linfocitos B que carecían de Caveolina-1 causaban- en modelos animales- manifestaciones clínicas similares a las descritas en pacientes con enfermedades autoinmunes, lo que ha posibilitado descubrir un modelo idóneo para el estudio de autoinmunidad causada por la incompleta activación de los linfocitos B. Estas células se generan a lo largo de nuestra vida en la médula ósea y allí son educadas para no reconocer y atacar nuestro propio organismo. De esta manera, los linfocitos B se vuelven “tolerantes” con el propio organismo.
Este estudio demuestra que este proceso educativo, o de establecimiento de tolerancia, depende de las señales transmitidas a través del BCR, y éstas a su vez, dependen de que Caveolina-1 organice correctamente estos receptores en la membrana de los linfocitos B.
La Dra. Susana Minguet comenzó el proyecto en 2008 en el laboratorio del Prof. Miguel Angel Del Pozo en el Centro Nacional de Investigaciones Cardiovasculares Carlos III, con el apoyo inicial de los proyectos del Prof. Del Pozo y posteriormente del programa Ramón y Cajal del Ministerio de Economía, Industria y Competitividad. En Julio del 2011, la Dra. Susana Minguet se trasladó a la Universidad de Friburgo como jefe de grupo independiente, continuando con el proyecto con el apoyo del Cluster of Excellence BIOSS Centre for Biological Signalling Studies y del Center for Chronic Immunodeficiency (CCI), y en estrecha colaboración con los grupos de los Profesores Miguel Angel Del Pozo (CNIC) y Michael Reth (Universidad de Friburgo y BIOSS).
Este estudio ha sido financiado por la Fundación Alemana para la investigación (DFG) a través del Proyecto de Investigación y Colaboración IMPATH (SFB-1160-P5), por el programa Ramón y Cajal y varios proyectos de investigación del MINECO, por la Worlwide Cancer Research Foundation, la Fundación Pro-CNIC y el Severo Ochoa Center of Excellence.
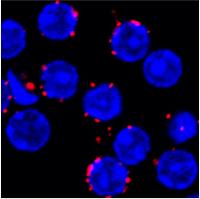
En linfocitos B (en azul en la imagen de microscopía confocal), la proximidad entre receptores (BCRs) se analiza mediante una técnica llamada PLA (del inglés, “Proximity Ligation Assay”) que genera señales fluorescentes en rojo cuando los receptores están una distancia menor de 20 nanómetros. Autor: Kathrin Kläsener