Jose Luis Cabrera Alarcón, PhD
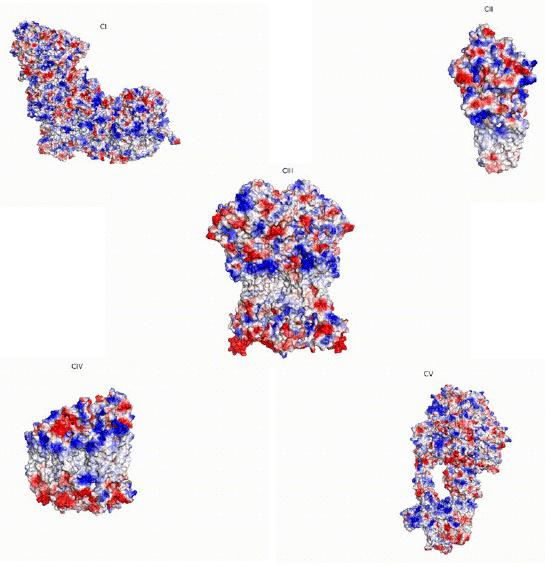
 Durante más de siete años como investigador postdoctoral en el grupo GENOXPHOS, hemos analizado el sistema OxPhos desde una perspectiva evolutiva integrada con su estructura tridimensional. Este enfoque nos permite vincular la evolución molecular con la organización espacial y las restricciones funcionales del sistema. Gracias a esta metodología, no solo podemos extrapolar información de otros grupos filogenéticos para realizar predicciones clínicas, sino también evaluar con mayor precisión la importancia relativa de posiciones específicas o conjuntos de posiciones dentro de OxPhos.
Durante más de siete años como investigador postdoctoral en el grupo GENOXPHOS, hemos analizado el sistema OxPhos desde una perspectiva evolutiva integrada con su estructura tridimensional. Este enfoque nos permite vincular la evolución molecular con la organización espacial y las restricciones funcionales del sistema. Gracias a esta metodología, no solo podemos extrapolar información de otros grupos filogenéticos para realizar predicciones clínicas, sino también evaluar con mayor precisión la importancia relativa de posiciones específicas o conjuntos de posiciones dentro de OxPhos.

Marta Pérez-Hernández Durán, PhD

Tras doctorarme en la Universidad Complutense de Madrid en electrofisiología cardíaca, realicé una primera etapa postdoctoral en la New York University (EEUU), donde estudié el funcionamiento de los cardiomiocitos en condiciones fisiológicas y en el contexto de la displasia arritmogénica del ventrículo derecho (ARVC, por sus siglas en inglés). Posteriormente, me incorporé al grupo GENOXPHOS para investigar el papel de la quinasa Fgr en el corazón.
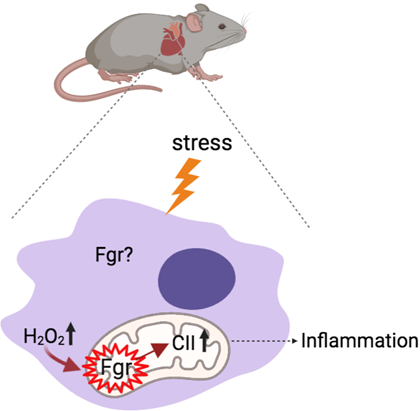
Nuestros estudios han demostrado que Fgr se activa bajo estrés celular y, en la mitocondria, fosforila el complejo II de la cadena transportadora de electrones, desencadenando una cascada que promueve la inflamación. Mi proyecto actual busca determinar si la inhibición de Fgr puede ejercer un efecto cardioprotector al reducir la inflamación cardiaca.
Para abordar esta cuestión, utilizamos distintos modelos experimentales (incluidos ratones Fgr-deficientes) en el contexto de envejecimiento, ejercicio, infarto de miocardio, aterosclerosis y ARVC, entre otros. En este marco, tenemos diversas colaboraciones:
- Con la New York University, en el contexto de un proyecto La Caixa Health, evaluamos si la inhibición de Fgr reduce la inflamación en un modelo murino de ARVC.
- Con el Hospital Universitario de Getafe, estudiamos el papel de Fgr en pacientes con infarto sin enfermedad coronaria obstructiva (MINOCA), dentro de un proyecto FIS.
- Además, colaboramos con la empresa Nostrum en el desarrollo y caracterización de nuevos inhibidores específicos de Fgr, con el objetivo de explorar su potencial terapéutico en enfermedades cardíacas que cursen con inflamación.
Por último, lidero un proyecto de Generación de Conocimiento orientado a caracterizar el papel de las mitocondrias en ARVC, con el fin de identificar nuevos mecanismos moleculares implicados en esta patología.
María Concepción Jiménez Gómez, PhD

Soy doctora en Biología Molecular por la Universidad Autónoma de Madrid (UAM) y, desde 2010, desarrollo mi carrera en el Centro Nacional de Investigaciones Cardiovasculares (CNIC) dentro del grupo Genoxphos, liderado por el Dr. Enríquez. Mi trabajo en el CNIC se ha centrado principalmente en la gestión integral de proyectos de investigación y en el impulso de iniciativas de desarrollo traslacional.
En el grupo Genoxphos he asumido la planificación, coordinación y supervisión de los proyectos científicos, incluyendo la gestión de cronogramas, recursos, presupuestos y relaciones con colaboradores nacionales e internacionales. También coordino las alianzas estratégicas con la industria farmacéutica, entre ellas colaboraciones con AstraZeneca y Minovia Therapeutics, con un papel clave en la interlocución científico-técnica y en la alineación de objetivos entre los equipos implicados.
Mi compromiso con una gestión eficiente me llevó a completar dos másteres en gestión y administración, que me han permitido optimizar los procesos internos del grupo y reforzar la toma de decisiones estratégicas. Actualmente curso el grado en Psicología, con el objetivo de integrar conocimientos en psicología comparada y del comportamiento en el diseño y ejecución de proyectos científicos.
Paralelamente a la labor de gestión, participo en proyectos de investigación centrados en el papel de la metaloproteasa mitocondrial OMA1 como integrador del estrés celular, en colaboración con la Dra. Yolanda Martí. Nuestros estudios han revelado que la deleción de OMA1 —tradicionalmente considerada protectora en ciertos contextos patológicos— puede favorecer la aparición de patologías hepáticas en modelos de ratón Oma1KO, incluyendo mayor mortalidad, predisposición a tumores primarios y progresión desde daño hepático temprano hacia inflamación crónica y fibrosis. Estos resultados sugieren un papel esencial de OMA1 en la protección frente a la enfermedad hepática crónica y la tumorogénesis mediante la regulación de la inmunogenicidad hepática.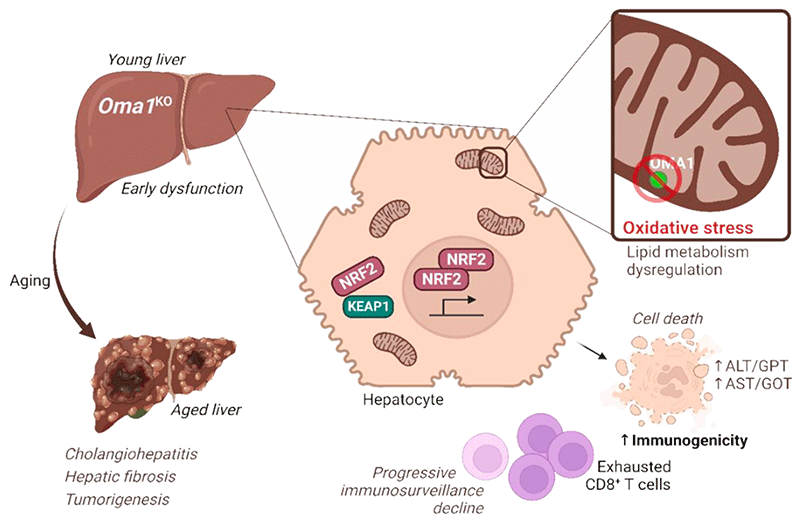
Raquel Justo Méndez
Me gradué en biología (Universidad Autónoma de Madrid), y actualmente estoy realizando mi doctorado en Biomedicina Molecular bajo la supervisión de José Antonio Enríquez y Ana Victoria Lechuga-Vieco. En este proyecto evaluamos el impacto de la comunicación entre la mitocondria y el núcleo durante la hematopoyesis en condiciones de distinta variabilidad mitocondrial. Nuestro estudio involucra perfiles inmunológicos, metabólicos y mitocondriales, centrándose en aspectos como la producción de ROS, la organización de los complejos respiratorios y la preferencia de sustratos para obtener energía.
Mediante el uso de ratones deficientes en la actividad correctora de la ADN polimerasa mitocondrial, examinamos el impacto de las células inmunes sobre el envejecimiento y la fragilidad, enfocándonos en la importancia de los mecanismos de control de calidad y de translación mitocondriales.
Carmen Morales Vidal
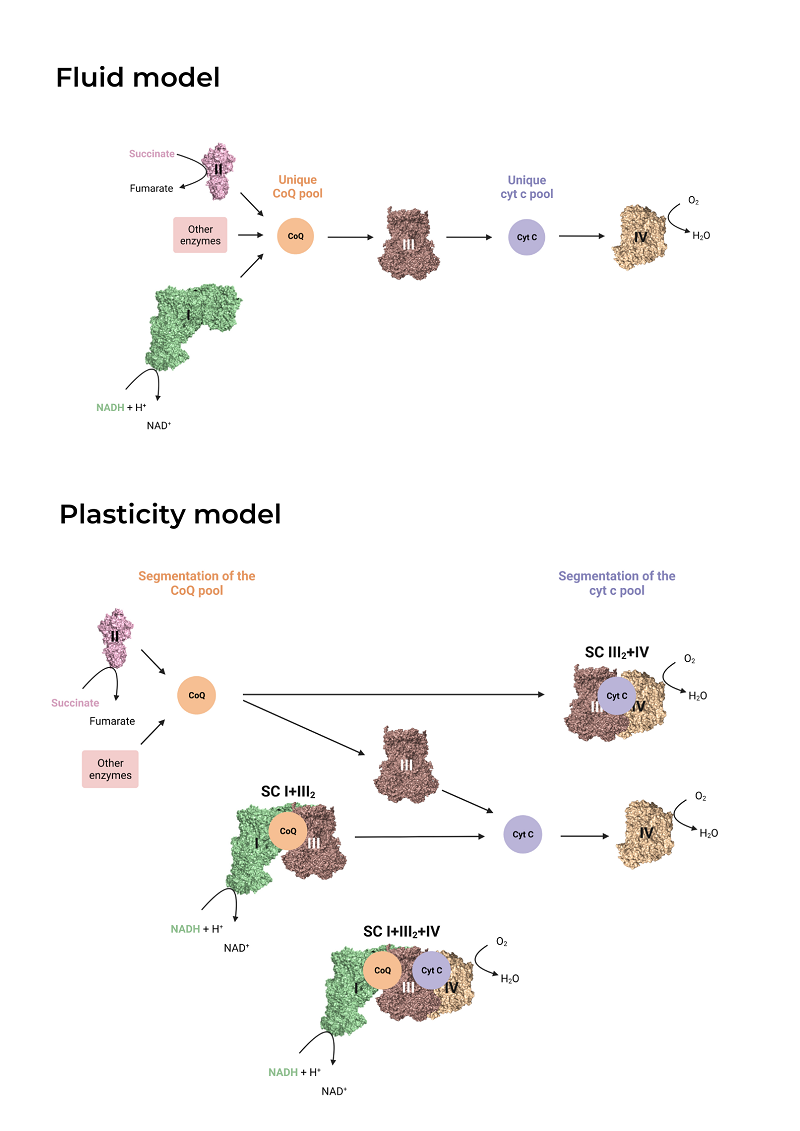
 Tras graduarme en Bioquímica y Ciencias Biomédicas en la Universidad de Valencia en 2020, me uní al grupo Genoxphos como estudiante de máster y, finalmente, como investigadora predoctoral. Actualmente me encuentro terminando de escribir la tesis. Mi proyecto trata de comprender la razón detrás del superensamblaje de los complejos mitocondriales I (CI) y III (CIII), una interacción que está altamente conservada en la naturaleza, desde levaduras hasta mamíferos, y que da lugar a supercomplejos como el I+III2 y el I+III2+IV. Se han propuesto varias funciones para esta asociación, entre ellas la canalización del sustrato de un complejo al otro, la reducción de la producción de especies reactivas de oxígeno o la estabilización de los complejos constituyentes. Con tal de estudiar en mayor profundidad el papel de la interacción I+III2 en la bioenergética y la morfología mitocondrial, he generado líneas celulares modificadas genéticamente en donde la interacción entre el CI y el CIII está interrumpida. Así, he podido observar que, en ausencia de superensamblaje I+III2, las mitocondrias reducen su respiración basal y máxima, producen más especies reactivas de oxígeno y son más sensibles a cambios de sustrato, entre otras observaciones. Estos modelos llenan un vacío en el campo, ya que hasta esta tesis no se disponía de un sistema vivo con pérdida de asociación CI-CIII, indispensable para clarificar su polémico rol en los seres vivos.
Tras graduarme en Bioquímica y Ciencias Biomédicas en la Universidad de Valencia en 2020, me uní al grupo Genoxphos como estudiante de máster y, finalmente, como investigadora predoctoral. Actualmente me encuentro terminando de escribir la tesis. Mi proyecto trata de comprender la razón detrás del superensamblaje de los complejos mitocondriales I (CI) y III (CIII), una interacción que está altamente conservada en la naturaleza, desde levaduras hasta mamíferos, y que da lugar a supercomplejos como el I+III2 y el I+III2+IV. Se han propuesto varias funciones para esta asociación, entre ellas la canalización del sustrato de un complejo al otro, la reducción de la producción de especies reactivas de oxígeno o la estabilización de los complejos constituyentes. Con tal de estudiar en mayor profundidad el papel de la interacción I+III2 en la bioenergética y la morfología mitocondrial, he generado líneas celulares modificadas genéticamente en donde la interacción entre el CI y el CIII está interrumpida. Así, he podido observar que, en ausencia de superensamblaje I+III2, las mitocondrias reducen su respiración basal y máxima, producen más especies reactivas de oxígeno y son más sensibles a cambios de sustrato, entre otras observaciones. Estos modelos llenan un vacío en el campo, ya que hasta esta tesis no se disponía de un sistema vivo con pérdida de asociación CI-CIII, indispensable para clarificar su polémico rol en los seres vivos.
Raquel Martínez de Mena, PhD

Tras obtener el doctorado en Ciencias por la Universidad Autónoma de Madrid y antes de incorporarme al equipo del Dr. José Antonio Enríquez, desarrollé mi labor investigadora en el ámbito del tejido adiposo marrón y de las hormonas tiroideas en el IIB Alberto Sols de Madrid.
A lo largo de los últimos 8 años en el CNIC, he aportado mi experiencia en técnicas bioquímicas y de Biología Molecular, aplicándola al estudio de la Genética Funcional del Sistema de Fosforilación Oxidativa.
Participo activamente tanto a nivel científico como técnico en los proyectos del grupo relacionados con metabolismo y fisiología mitocondrial, utilizando modelos celulares y de ratón.
María del Mar Muñoz Hernández

Me uní al grupo GENOXPHOS en 2014, tras finalizar mi formación como técnico de laboratorio en Anatomía Patológica y Citología.
Dentro del grupo, participo activamente en diversas líneas de investigación, con especial dedicación al manejo de modelos animales experimentales. Mi labor abarca la cría y caracterización genética, además de contar con formación específica en técnicas quirúrgicas —principalmente cardíacas— y en la realización de análisis metabólicos y de comportamiento vinculados al estudio del envejecimiento.

Eva Raquel Martínez

Como técnico de laboratorio, soy responsable de realizar experimentos, analizar muestras y realizar pruebas en un laboratorio. Mi función a menudo implica el uso de diversos instrumentos científicos y garantizar el registro preciso de datos con fines de investigación o diagnóstico.
Dichas técnicas van desde el genotipado de DNA hasta el tratamiento de muestras tisulares con fines diagnósticos.
Marina Rosa Moreno


Paula Fernández-Montes Díaz

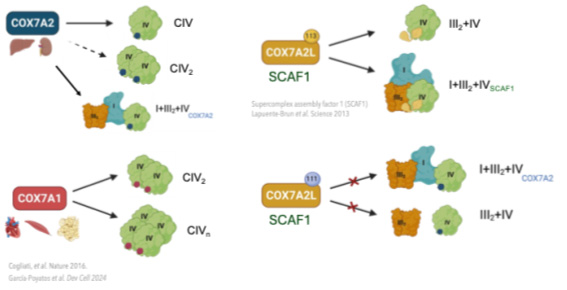
Después de graduarme en Biología en la Universidad Autónoma de Madrid, me uní al grupo GENOXPHOS como estudiante de máster y, finalmente como investigadora predoctoral. En mi tercer año como investigadora predoctoral, estudio el papel de isoformas alternativas del complejo IV, en concreto la familia COX7A. El complejo IV (citocromo oxidasa c) es el último complejo de la cadena de transporte de electrones y está sometido a un gran nivel de regulación. La familia COX7A está conformado por diferentes isoformas: COX7A1, COX7A2 y COX7A2L o SCAF1. Las subunidades alternativas COX7A confieren al complejo IV distinta organización supramolecular, pudiendo aparecer en forma monomérica, dímeros, multímeros y superensamblado con otros complejos formando el respirasoma-Q y el respirasoma-N (Cogliati y Calvo, et al. Nature 2016).
Utilizando modelos murinos y celulares, hemos visto que las estructuras supramoleculares del complejo IV tienen funciones metabólicas y fisiológicas distintas, yendo desde la viabilidad del organismo, la maduración metabólica necesaria para la correcta fisiología tisular, hasta la plasticidad y adaptación a distintos requerimientos metabólicos.
Michaela Veliova, PhD

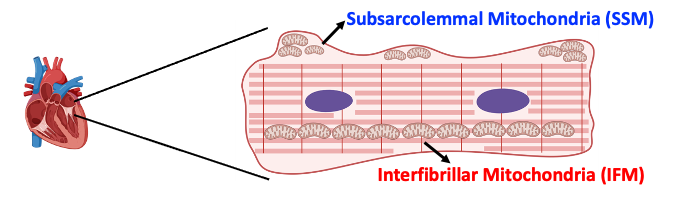
Completé mi maestría en Biotecnología en Viena, Austria, y luego obtuve mi doctorado en Farmacología Molecular y Médica en la University of California, Los Ángeles (UCLA). Como investigadora posdoctoral en el laboratorio GENOXPHOS, estudio la diversidad intracelular de las mitocondrias en los cardiomiocitos, enfocándome en las diferencias funcionales entre las mitocondrias interfibrilares (IFM) y las mitocondrias subsarcolemmales (SSM), dos mitotipos con roles distintos en la fisiología cardiaca. Mi investigación actual analiza cómo el entorno subcelular, particularmente los ribosomas citoplasmáticos, contribuye a la diferenciación de los mitotipos, buscando comprender cómo se regula la expresión diferencial de proteínas y cómo el microambiente celular moldea los proteomas y la función mitocondrial. A través de este trabajo, busco descubrir los principios que impulsan la especialización y diversidad mitocondrial dentro de los cardiomiocitos, así como entender cómo estas especializaciones funcionales cambian durante la enfermedad o el envejecimiento.
Rebeca Acín

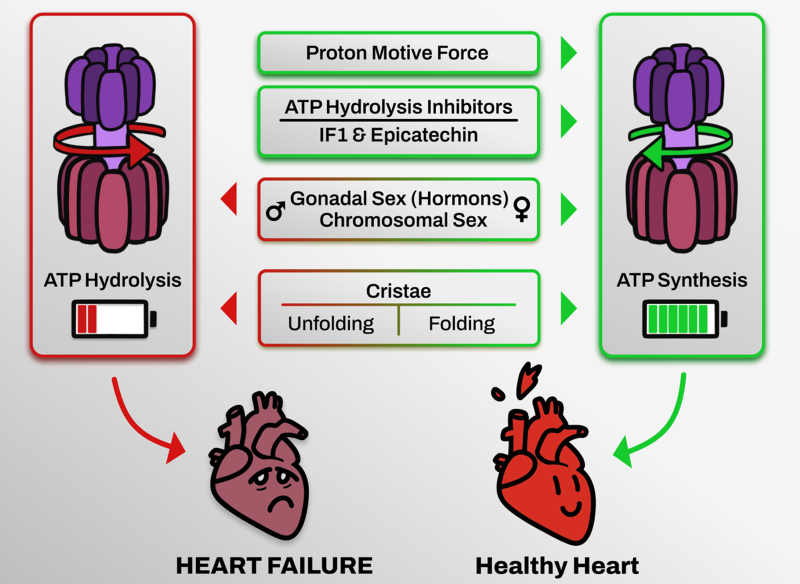
Mi línea de investigación se centra en el estudio del papel de la mitocondria en el fallo cardiaco. En particular, mi proyecto aborda cómo la depleción de ATP —originada por el funcionamiento en modo reverso del Complejo V o ATPasa mitocondrial— contribuye al fenotipo adverso asociado a la disfunción cardiaca. Trabajos recientes de nuestro grupo han demostrado que la inhibición de esta actividad reversa del Complejo V ejerce un efecto beneficioso, mejorando el rendimiento mitocondrial en situaciones de estrés o patología mitocondrial. La extrapolación de estos hallazgos a modelos de insuficiencia cardiaca permitirá identificar nuevas dianas y estrategias terapéuticas para frenar el deterioro progresivo del corazón en enfermedades cardiovasculares.
Desde el punto de vista mas molecular, mi proyecto se centra en estudiar las distintas formas de ensamblaje del Complejo V para dilucidar el papel de cada una de ellas en su contribución a síntesis o hidrólisis de ATP. Para ello, disponemos de modelos animales y celulares mutantes de ensamblaje en el Complejo V.
Sara Natalia Jaroszewicz

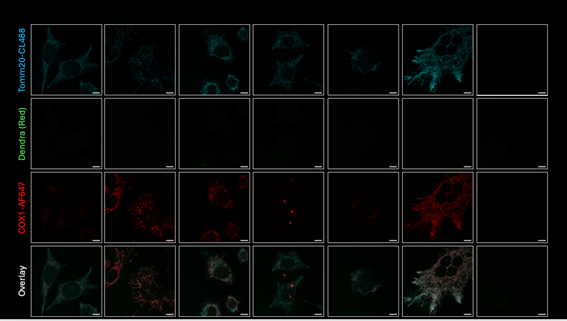
Me gradué en Bioquímica en la Universidad Autónoma de Madrid en 2022 y me incorporé al grupo en verano de ese mismo año como estudiante de prácticas CICERONE y posteriormente como estudiante de Máster. Mi tesis doctoral consiste en descifrar la organización in situ de la cadena de transporte de electrones mediante técnicas de superresolución.
Las mitocondrias son orgánulos esenciales en el metabolismo celular eucariota. En ellas ocurre la fosforilación oxidativa, un proceso mediado por complejos respiratorios (RCs), que pueden ensamblarse en estructuras macromoleculares conocidas como supercomplejos (SCs). Aunque la existencia de los SCs ha sido demostrada, todavía existen dudas acerca de cómo se organizan realmente estos complejos en la membrana mitocondrial interna y cómo su proporción podría influir en el desarrollo de enfermedades cardiacas. Para responder a estas preguntas, mi proyecto se centra en la optimización de los métodos de superresolución STED, Expansion Microscopy (iU-ExM) y proximity ligation assay (PLA) con el fin de visualizar SCs in situ, determinar su posición fisiológica en subdominios de las crestas mitocondriales y compararlos cuantitativamente en un modelo murino de insuficiencia cardiaca.

Carolina Amalia Simón Guerrero
Tras tres años de experiencia como bioinformática desarrollando y manteniendo software científico y herramientas de análisis de datos (centrados principalmente en biología estructural y microscopía crioelectrónica), me incorporé al laboratorio GENOXPHOS para contribuir al desarrollo de una plataforma bioinformática integrada para el análisis exhaustivo de la fisiopatología del sistema OxPhos.