El corazón es una máquina mecánica con poco margen de error. Aún no comprendemos cómo las moléculas que conforman el corazón aseguran la destacable fiabilidad de este órgano. En este contexto, nuestro foco se centra en las siguientes cuestiones: ¿Cómo emergen las propiedades mecánicas de proteínas como la titina o la proteína C de unión a miosina (cMyBP-C) a la escala de tejido para establecer la mecánica global del miocardio? ¿Cómo se modula la mecánica de proteínas durante la adaptación fisiológica del corazón y cómo se altera en enfermedades cardiacas? ¿Cómo variantes genéticas en proteínas con función mecánica desencadenan el desarrollo de miocardiopatías? Nuestro laboratorio intenta responder a todas estas cuestiones siguiendo una aproximación multidisciplinar, siempre tratando de desarrollar nuevos métodos y de contar con destacados colaboradores cuando es posible. Uno de nuestros puntos fuertes es nuestro dominio de técnicas biofísicas de manipulación de moléculas individuales para la caracterización mecánica de proteínas, incluyendo la espectroscopía de fuerzas por microscopía de fuerza atómica (AFM) y pinzas magnéticas (MT), así como métodos computacionales complementarios. Para proveer a nuestros resultados de un contexto biológico, también medimos mecánica a nivel de miocardiocitos y preparaciones de miocardio y aprovechamos nuestra experiencia en bioquímica de proteínas y biología molecular y celular. En nuestra persecución de una mayor contextualización biológica, recientemente hemos expandido nuestra capacidad de manipulación mecánica de proteínas a células y animales vivos. Puedes encontrar más información sobre los proyectos actuales del laboratorio más abajo.
Puedes acceder a la lista de publicaciones de Jorge aquí.

Mecánica de proteínas in vivo
Con el objetivo de llevar el campo de la mecánica de proteínas desde las correlaciones a la causalidad, nos comprometemos con el desarrollo de métodos que permitan estudiar la mecánica de proteínas in vivo. Muchas de estas herramientas se basan en el uso de proteasas específicas para interrumpir la transducción de fuerzas por parte de proteínas mecánicas a voluntad. Nuestros esfuerzos están financiados por el programa ERC-Consolidator (proyecto Prot-Mechanics Live) y se basan en el modelo de ratón HaloTag-TEV titin, que reportamos en Nature Communications 2020, 11, 2060 en colaboración con el grupo de Wolfgang Linke (U. Münster). La aplicación de esta estrategia a titina está produciendo resultados que hasta la fecha resultaban inaccesibles y que actualmente estamos estudiando en profundidad. Aún no hemos publicado nuestros resultados, pero si tienes interés, envía un mensaje a Jorge: ¡nos encantaría contribuir con nuestras herramientas a explorar preguntas relevantes fuera de nuestra zona de confort!
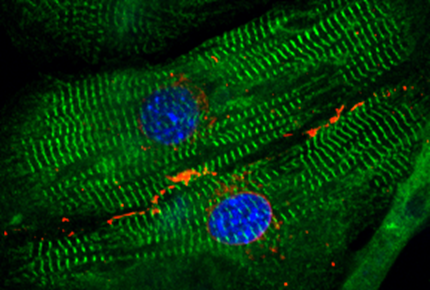
Estructuras generadoras de fuerza en miocardiocitos
Comunicación cruzada entre la mecánica de proteínas y la fisiopatología del corazón
Dentro de nuestro interés general por comprender cómo la mecánica de proteínas contribuye a la fisiopatología del corazón, una de las líneas de investigación tradicionales de nuestro laboratorio ha estado dedicada al estudio de modificaciones postraduccionales óxido-reductoras en cisteínas como potentes reguladoras de la mecánica de titina (Cell 2014, 156(6):1235, Nature Communications 2018, 9: 185, revisado en Redox Biology 2019, 21:101074). Recientemente, hemos demostrado que estas oxidaciones ocurren en titina in vivo (Redox Biology 2022, 52:102306), lo que abre nuevas cuestiones acerca de su origen biológico y cómo los miocardiocitos aprovechan estas modificaciones para modular su propia mecánica. Impulsados por estos resultados, ahora estamos investigando las consecuencias mecánicas de otras modificaciones postraduccionales predominantes en enfermedades del corazón y que pueden contribuir a su fisiopatología.
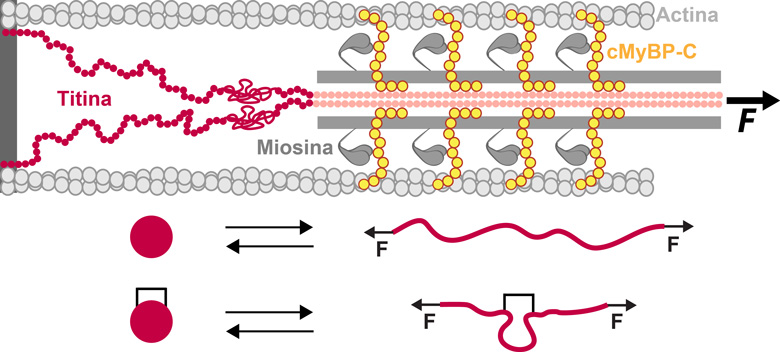
Titina y cMyBP-C son proteínas con función mecánica en el sarcómero muscular.
El desplegamiento de dominios de proteína bajo fuerza mecánica se ve
afectado cuando existen modificaciones postraduccionales entrecruzantes.
Proteínas mecánicas y el origen de miocardiopatías familiares
La miocardiopatías familiares son enfermedades genéticas del corazón que dan cuenta de la mayoría de casos de muerte súbita en jóvenes. También son la primera causa de trasplante cardiaco en el mundo. Mutaciones en genes que codifican proteínas mecánicas son la causa más común de miocardiopatía, aunque las razones permanecen ampliamente desconocidas. Recientemente hemos demostrado que propiedades físico-químicas específicas, como la hidrofobicidad reducida de residuos localizados en el interior de dominios proteicos, son características de variantes patogénicas de titina que causan miocardiopatía dilatada (DCM) (Cell Reports 2023, 42, 113490). Ahora estamos investigando por qué, con el objetivo final de encontrar nuevas ventanas de oportunidad terapéutica para esta enfermedad. También estamos interesados en miocardiopatía hipertrófica (HCM), la enfermedad genética del corazón más común. A partir de nuestra observación de que muchas variantes patogénicas de cambio de sentido en cMyBP-C que causan HCM no muestran ninguno de los fenotipos moleculares patogénicos clásicos (J Biol Chem 2021, 297, 100854, ACS Nano 2021, 15, 10203), hemos desarrollado nuevos modelos animales para testar nuevos mecanismos patogénicos y probar la potencial eficacia de terapias para este importante grupo de pacientes (puedes leerlo en BIORXIV/2024/584986).
Charla de Jorge durante la recogida del premio Michael and Kate Bárány








