ACS Nano: Descrito un potencial mecanismo patogénico en el desarrollo de miocardiopatía hipertrófica
El equipo del Dr. Jorge Alegre-Cebollada del CNIC explica, por primera vez, la asociación entre las alteraciones mecánicas de un componente de la maquinaria contráctil del corazón y el desarrollo de esta enfermedad
Investigadores del Centro Nacional de Investigaciones Cardiovasculares (CNIC) describen un potencial mecanismo patogénico en el desarrollo de miocardiopatía hipertrófica (MCH), la enfermedad genética del corazón más común. El estudio, publicado en la revista ACS Nano describe, por primera vez, la asociación entre alteraciones mecánicas de un componente de la maquinaria contráctil del corazón y el desarrollo de esta enfermedad.
El músculo cardiaco se encuentra sometido a continuo estrés mecánico durante toda la vida humana, contrayéndose para bombear sangre por el organismo. El laboratorio dirigido por el Dr. Jorge Alegre-Cebollada investiga cómo las propiedades mecánicas de las proteínas cardiacas determinan el comportamiento fisiológico de este músculo y cómo su alteración condiciona la aparición de trastornos como la MCH. Esta enfermedad, en la que el ventrículo izquierdo se engrosa anormalmente, señala el Dr. Alegre-Cebollada es la más común entre las dolencias hereditarias que afectan al músculo cardiaco y sus manifestaciones más graves incluyen la muerte súbita y la insuficiencia cardiaca.
Desde hace más de 20 años se sabe que diferentes mutaciones en proteínas con función mecánica en los miocardiocitos causan miocardiopatía hipertrófica. Uno de los retos de la genética cardiovascular es identificar qué variantes genéticas que se dan en pacientes y sus familias son patogénicas. Saber si una mutación es patogénica o no es importante porque define el tipo de seguimiento clínico de los miembros de una familia y, potencialmente, su tratamiento.
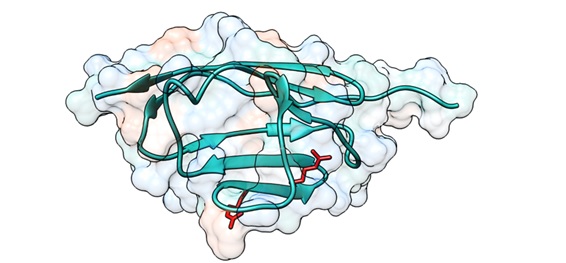
En el estudio que ahora se publica y que ha sido coordinado por el Dr. Jorge Alegre-Cebollada, se ha analizado la proteína c de unión a miosina (cMyBP-C)
Según explica la primera autora del artículo, Carmen Suay-Corredera, la proteína cMyBP-C, con función mecánica en la regulación de la contracción cardiaca, es la proteína más frecuentemente mutada en pacientes con MCH y uno de los focos de estudio del grupo del Dr. Alegre-Cebollada. “Una proporción significativa de mutaciones en cMyBP-C causa cambios de aminoácido en la proteína; sin embargo, los mecanismos patogénicos por los que provocan MCH siguen sin conocerse con precisión”.
El grupo del Dr. Alegre-Cebollada, en estrecha colaboración con investigadores clínicos y moleculares en Europa y EEUU, ha configurado una base de datos de variantes en cMyBP-C ligadas inequívocamente con el desarrollo de MCH para estudiar los defectos moleculares asociados a enfermedad.
Gracias al uso de técnicas bioinformáticas y experimentales, han descubierto que alrededor de la mitad de estas variantes afecta a la integridad del ARN mensajero o de la proteína. Estos resultados ya han sido aceptados para su publicación en la revista Journal of Biological Chemistry, y han dado lugar a un comentario en la revista de referencia en genética médica, Genetics in Medicine.
Aunque alteraciones en la integridad del RNA mensajero o proteína pueden explicar la patogenicidad de la mitad de las mutaciones estudiadas en estos trabajos, matiza Suay-Corredera, es importante enfatizar que la otra mitad no causa enfermedad por estas vías.

“Y son precisamente estas variantes con mecanismo patogénico desconocido las que se ha analizado en este artículo”, señala el Dr. Alegre-Cebollada, que dirige el Grupo de Mecánica Molecular del Sistema Cardiovascular en el CNIC.
Así, gracias al uso de técnicas biofísicas avanzadas basadas en microscopía de fuerza atómica, este equipo, describe, por primera vez, cómo algunas de estas mutaciones patogénicas en cMyBP-C inducen defectos en las propiedades mecánicas de la proteína que pueden desembocar en la alteración de la función contráctil de los miocardiocitos en MCH.
Actualmente, “estamos buscando mecanismos patogénicos para aquellas variantes en las que todavía no se ha detectado ninguna alteración relevante en los estudios anteriores”, afirma el Dr. Alegre-Cebollada. Para ello, trabajan con distintos modelos experimentales, desde sistemas moleculares hasta modelos animales de la enfermedad.
La descripción de mecanismos moleculares en MCH es clave para la identificación de mutaciones patogénicas en cMyBP-C, y, por tanto, para el seguimiento clínico y potencial tratamiento de los pacientes y sus familias, concluyen los investigadores.
La investigación ha sido financiada por el Ministerio de Ciencia e Innovación (MCIN), la Red Europea de Investigación en Enfermedades Cardiovasculares (ERA-CVD/Instituto de Salud Carlos III, consorcio MINOTAUR), la Comunidad de Madrid, los Institutos Nacionales de la Salud de EEUU (NIH), el Gobierno Vasco, el Ministerio Italiano de Educación, Universidades e Investigación, y Becas Postdoctorales Stanford Dean y del Instituto Maternal and Child Health de Stanford.
Además, han colaborado en este trabajo investigadores del Centro de Investigación Biomédica en Red (CIBERCV).