Reformulan el funcionamiento de las mitocondrias y explican cómo las células generan energía a partir de los nutrientes
Science - 28 de junio de 2013
- El hallazgo, publicado en la revista Science, supone una redefinición del funcionamiento de esta parte de la célula y hará que cambien los libros de texto de la asignatura de bioquímica
- El descubrimiento de las enfermedades mitocondriales hizo replantearse los modelos que explicaban el funcionamiento de esta parte de las células
- El descubrimiento plantea dudas sobre cómo interpretar y trasladar a humanos las observaciones realizadas en la estirpe de ratón más utilizada en estudios genéticos de laboratorio
- El trabajo se ha desarrollado por investigadores del CNIC y la Universidad de Zaragoza y en él han colaborado los Hospitales Universitarios de La Princesa de Madrid y Miguel Servet de Zaragoza así como las universidades de Oviedo, Santiago de Compostela, y Pablo de Olavide de Sevilla
Madrid, 28 de junio de 2013.- Un equipo de investigadores españoles liderado por el Dr. José Antonio Enríquez, del Centro Nacional de Investigaciones Cardiovasculares (CNIC) publica hoy en Science un hallazgo que, con toda seguridad, hará modificar los libros de textos de bioquímica, ya que supone una completa reformulación del funcionamiento de la mitocondria y explica cómo las células generan energía a partir de los nutrientes.
El hallazgo supone la confirmación de una propuesta realizada en 2008 por los mismos investigadores consecuencia de observaciones que no podían ser explicadas por el modelo que hasta entonces describía como funcionaba la mitocondria, una parte del interior de las células que, entre otras tareas, se encarga de extraer y convertir la energía de los alimentos en formas utilizables por las células para sus propios procesos vitales.
El consumo, digestión y asimilación de alimentos en el cuerpo tiene por objeto final alimentar a todas y cada una de las células que lo constituyen. En todo este proceso, que ocurre en el exterior de las células, se consume energía, pero es necesario para desmenuzar y romper los componentes de los alimentos en compuestos sencillos como la glucosa de los azúcares, los amino ácidos de las proteínas y los ácidos grasos de las grasas. Estos componentes desmenuzados pueden entrar en las células y ser procesados en sus mitocondrias para generar energía.
“Entender cómo ocurre la generación de energía en las células es fundamental para entender la vida y, durante gran parte del siglo pasado, fue el objeto de estudio de la bioquímica. A finales de los 70 y principios de los 80 se consideró que el misterio de cómo la mitocondria realizaba esta tarea estaba resuelto y en los 90 se obtuvo un increíble detalle de las estructuras moleculares que lo realizaban. Se consideraba el proceso mejor conocido y mejor entendido de cuantos sucedían en la célula”, explica el Dr. Enríquez, investigador principal del estudio publicado en Science.
La descripción de las enfermedades mitocondriales cambió por completo esta percepción. Se constató que la formidable acumulación de conocimiento sobre este proceso resultaba insuficiente para entender las manifestaciones y síntomas de estas enfermedades. Los investigadores y médicos no podían anticipar por qué, dónde, cómo, cuándo y quién desarrollaría estas enfermedades, ni cuán severas podría llegar a ser. Así mismo, no ha permitido desarrollar tratamientos para las mismas. Esta realidad puso de manifiesto dos aspectos fundamentales. Por un lado, que el conocimiento de la función mitocondrial era mucho menor de lo que se creía y por otro que los modelos desarrollados para explicarla eran muy incompletos. Por esta razón durante los últimos 10 años se han acumulado estudios orientados a entender mejor este proceso.
El científico del CNIC añade que el trabajo supone que el modelo formulado en 2008 por su grupo es correcto. “Se redefine uno de los procesos fundamentales para la vida en todas las células”, subraya.
La ruptura de las moléculas de alimento se almacena en la célula en forma de electrones de alta energía, pero en dos tipos de molécula: las N o las F, cuya proporción varía según el tipo de alimento. Estas moléculas no pueden liberar energía de forma fácil y universal para desarrollar los procesos necesarios para la supervivencia, mantenimiento, crecimiento y división celulares ni para su coordinación.
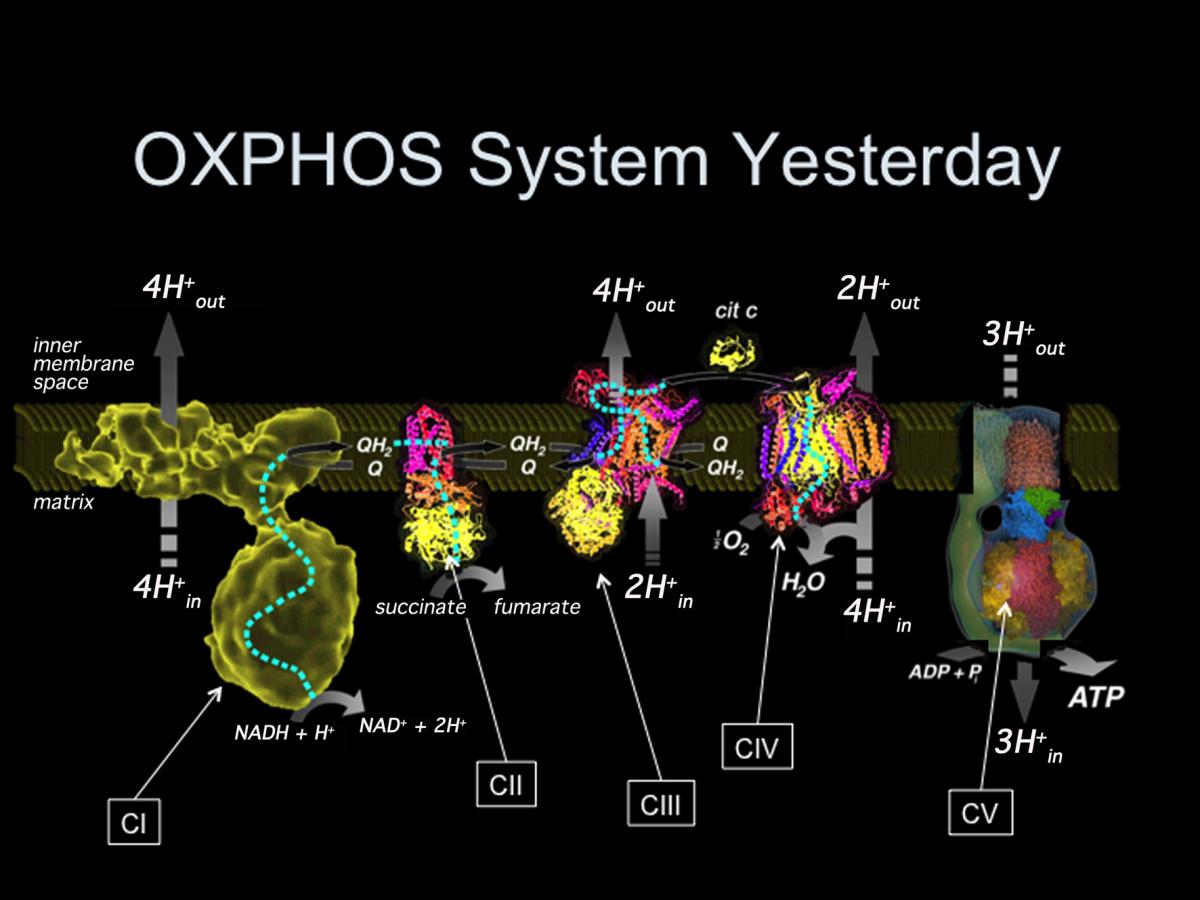
Es ahí donde entra en juego la mitocondria que, a través de cinco máquinas moleculares, los complejos I, II, III, IV y V, convierte la energía en una molécula utilizable universalmente, llamada ATP.
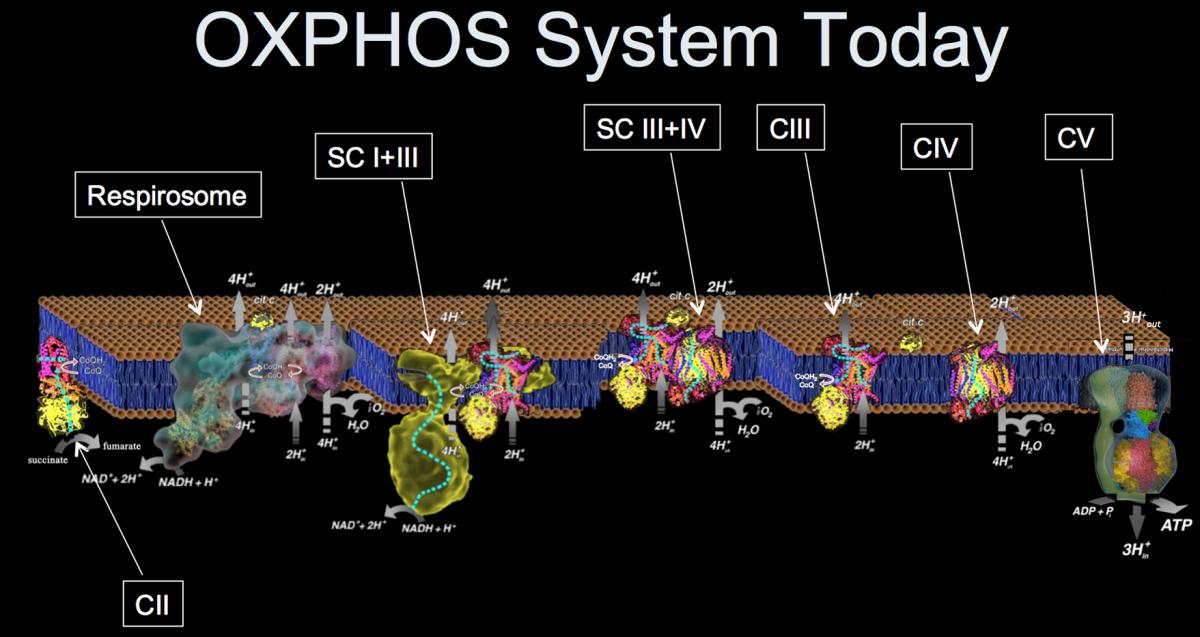
Hasta hace muy poco se aceptaba que estos complejos “nadaban” libres en la membrana interna de la mitocondria y no interaccionaban entre sí, algo que se ha demostrado incorrecto en el trabajo realizado en el CNIC. “Los cinco complejos no se mueven siempre de forma independiente en la membrana” explica el Dr. Enríquez. “Por el contrario, se asocian físicamente en combinaciones distintas denominadas supercomplejos respiratorios (SCI). “Nuestro trabajo explica las consecuencias funcionales de estas interacciones”.
Según se detalla en el artículo, estas asociaciones son dinámicas y se modifican para optimizar la extracción de energía de las moléculas F y N dependiendo de su abundancia, es decir, dependiendo de los alimentos que se hayan consumido.
En el trabajo de Science se describen estos supercomplejos y sus funciones. “Lo que quiere decir es que el sistema para optimizar la extracción de energía de los alimentos es mucho más versátil de lo que se creía y puede modularse de formas inesperadas para ajustar a la composición de los alimentos de la dieta o especializarse para funciones específicas en tipos celulares concretos”, añade el Dr. Enríquez.
Por último, los investigadores detallan que, fruto de su estudio, se ha llevado a cabo un “descubrimiento inesperado”. Así, la estirpe de ratón más utilizada en estudios genéticos de laboratorio tiene el mecanismo de generación de súper complejos respiratorios dañado, por lo que se han planteado dudas de cómo interpretar y trasladar a los humanos las observaciones realizadas en estos modelos de ratón.
E. Lapuente-Brun, R. Moreno-Loshuertos, R. Acin-Perez, A. Latorre-Pellicer, C. Colas, E. Balsa, E. Perales-Clemente, P. M. Quiros, E. Calvo, M. A. Rodriguez-Hernandez, P. Navas, R. Cruz, A. Carracedo, C. Lopez-Otin, A. Perez-Martos, P. Fernandez-Silva, E. Fernandez-Vizarra, J. A. Enriquez.Supercomplex Assembly Determines Electron Flux in the Mitochondrial Electron Transport Chain. Science, 2013; 340 (6140): 1567 DOI: 10.1126/science.1230381
- Diario Médico. Un equipo multicéntrico español reformula la función imperante de la mitocondria
- La Voz de Galicia. Un equipo español explica cómo las células generan energía
- Diario Médico. Un equipo multicéntrico español reformula la función imperante de la mitocondria
- La Voz de Galicia. Un equipo español explica cómo las células generan energía
- El Mundo. La mitocondria se queda vieja en los libros de texto
- ABC. Investigadores españoles reformulan el funcionamiento de las mitocondrias
- Science Daily. Researchers Reformulate the Model of Mitochondrial Function










